ACI/MACI
Introducción
Históricamente, el manejo más común del daño articular ha sido el desbridamiento, con el objetivo de minimizar los síntomas. Esto podía aliviar el dolor durante un periodo de tiempo, pero no alteraba la historia natural del problema. Por el contrario, las nuevas opciones de manejo buscan tener un impacto positivo en el área afectada del cartílago, proporcionando acceso a células progenitoras que estimulen la cicatrización del defecto con un material parecido al cartílago o trasplantando células, ya sean condrocitos diferenciados o células pluripotentes, que puedan regenerar cartílago(1).
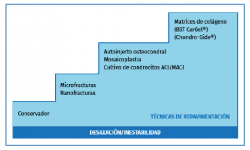
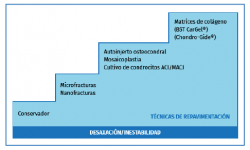
Las opciones de manejo han ido evolucionando (Figura 1):
a) Estimulación medular o técnicas de reparación: las microfracturas que favorecen la formación de un coágulo de sangre con células mesenquimales.
La ventaja de esta técnica es que se puede utilizar como primera opción de manejo en lesiones inestables, es fácil de reproducir y económica. Los resultados son buenos en lesiones de tamaño < 1,5 cm2(2).
La desventaja de esta técnica es que está limitada a lesiones de pequeño tamaño (< 1,5 cm2), poca profundidad y la durabilidad de la reparación es limitada. El tejido que se produce es fibrocartílago y no cartílago hialino.
b) Sustitución del cartílago mediante el implante autólogo osteocondral: la mosaicoplastia(3,4).
Ofrece la ventaja de reparar un defecto estructural de mayor tamaño de superficie y profundidad. El implante lleva consigo colágeno de tipo II y hueso subcondral.
Las principales limitaciones de esta técnica son el tamaño de la lesión y la morbilidad de la zona donante.
c) Terapia regenerativa basada en células.
• Primera generación: implantación de condrocitos autólogos (autologous chondrocyte implantation –ACI–).
• La segunda generación: implantación con membrana de condrocitos autólogos (membrane autologous chondrocyte implantation –MACI–).
– La técnica ACI se utilizó por primera vez en 1994 por Brittberg et al.(5) en pacientes con lesiones osteocondrales de la rodilla. Los condrocitos se obtienen de una zona sin carga de la rodilla, se expanden in vitro antes de reimplantarse en un segundo tiempo en el defecto articular, bajo la cobertura de una capa de periostio. El tiempo quirúrgico del reimplante es abierto y precisa de una artrotomía.
Las ventajas de esta técnica vienen dadas por el propio aporte de condrocitos autólogos capaces de sintetizar colágeno de tipo II y por disminuir el defecto de la zona donante de la rodilla gracias a su posterior expansión in vitro.
Los inconvenientes que llevaron a evolucionar esta técnica fueron: evitar la morbilidad que supone la obtención del periostio del paciente y el sobrecrecimiento del mismo.
– La técnica MACI (ACI de segunda generación) utiliza una membrana de colágeno en lugar del periostio. Esta técnica disminuye la morbilidad y, dependiendo del lugar de la lesión, hay autores que consiguen cubrir el defecto de forma artroscópica sin necesidad de una osteotomía articular.
d) Terapias regenerativas basadas en células madre pluripotenciales inducidas o células mesenquimales. Estas líneas celulares están soportadas por una matriz de colágeno que se adapta al defecto en casa caso. Este tema se aborda en otro capítulo.
Indicaciones de la terapia
Las técnicas ACI/MACI están indicadas en aquellos pacientes con una lesión osteocondral (LOC) inestable, sintomática y limitante en sus actividades diarias. El paciente ha debido agotar las líneas de manejo conservador y rehabilitador. A su vez, el candidato no debe presentar desaxaciones en miembros inferiores ni inestabilidad articular del tobillo.
En línea con lo anterior, es importante la evaluación del paciente, identificar el tamaño y la localización de la lesión, e identificar si coexisten una inestabilidad ligamentosa o una desaxación que requiera ser tenida en cuenta. Se requiere formalizar una correcta historia clínica y un examen físico para valorar con precisión el nivel de sintomatología y el grado de deterioro funcional.
Como pruebas complementarias, se requieren unas radiografías estándar en carga anteroposterior y lateral de los tobillos. La resonancia nuclear magnética (RNM) es la prueba de imagen con mayor sensibilidad, pero puede sobrevalorar el tamaño de la lesión si existe edema óseo. Un signo de buen pronóstico en el seguimiento de la lesión es la desaparición en la imagen del edema subcondral a los 3-4 meses del accidente. La tomografía axial computarizada (TAC) informa sobre el tamaño exacto de la lesión, la localización y la existencia de quistes subcondrales. La sensibilidad no es tan alta como en la RNM pero la valoración del estado del hueso subcondral y la especificidad en el diagnóstico son mayores.
La mayoría de las LOC del astrágalo, sin tener en cuenta la localización, muestran buenos resultados con el desbridamiento y las microfracturas, pero las lesiones mayores de 1,5 cm2 presentan peores resultados cuando se manejan únicamente con esta técnica. Un estudio sistemático de 2008(2) obtuvo un 85% de tasa de éxito cuando el tamaño de la lesión no superaba los 1,5 cm2.
De acuerdo con estas observaciones, se considera una primera línea de manejo el tratamiento con desbridamiento artroscópico y microfracturas y una segunda línea de tratamiento las técnicas ACI/MACI en aquellos casos que han fracasado previamente. En las lesiones que superen los 1,5 cm2, las técnicas ACI/MACI pueden utilizarse como primera opción de tratamiento.
En la Tabla 1 se resumen las indicaciones de las técnicas ACI/MACI en el tratamiento de las LOC del astrágalo(6).
Técnica quirúrgica
Técnica ACI
La técnica ACI es un procedimiento en 2 fases. La primera fase implica el aislamiento, cultivo y proliferación de los condrocitos. Mediante la artroscopia de rodilla o tobillo se obtiene una muestra de cartílago articular para cultivar los condrocitos. La técnica original obtenía el cartílago de muestra de la tróclea o el cóndilo femoral externo de la rodilla. Posteriormente, el procedimiento evolucionó y la obtención del injerto condral en las lesiones del astrágalo puede ser del propio tobillo. La artroscopia del tobillo nos permite valorar al mismo tiempo el estado articular y objetivar la LOC. Este acto quirúrgico requiere de un consentimiento informado y un test de despistaje viral previo al cultivo.
El primer tiempo implica la realización de una artroscopia de cámara anterior de tobillo a través de los portales estándar anterolateral y anteromedial. Se evalúa la LOC, el estado del cartílago circundante y se palpa el defecto para determinar la extensión de cualquier pérdida ósea subcondral. Se desbrida la lesión y se elimina el tejido patológico e inestable. Cuando las pruebas de imagen preoperatorias muestran quistes óseos, se realiza con especial cuidado la fase de examen de la LOC. Si se presenta un quiste talar sin comunicación con el cartílago, se realizará un desbridamiento retrógrado del quiste. Este desbridamiento se puede realizar en el segundo tiempo junto con aporte de injerto óseo de esponjosa de la tuberosidad del calcáneo, la región metafisaria de la tibia proximal, distal, maléolo lateral o de la cresta iliaca.
La muestra de cartílago obtenida en el primer tiempo artroscópico se transporta al laboratorio para el cultivo de los condrocitos. Los portales artroscópicos se cierran con nailon de 3.0 y se inmoviliza parcialmente con un vendaje algodonado compresivo. Se permite al paciente la carga completa del miembro intervenido.
El cultivo de los condrocitos lleva unas 3-4 semanas. Las técnicas de aislamiento y cultivo se realizan de acuerdo a las señaladas por Harrison PE et al.(7).
El segundo tiempo quirúrgico es abierto y dependiente de la localización de la LOC: a) una osteotomía en Chevron del maléolo tibial medial; o b) una osteotomía oblicua del peroné, bajo control por escopia, permiten acceder al borde medial o lateral de la cúpula talar. La orientación de la osteotomía es importante para permitir un acceso adecuado(8). Le lesión se desbrida para asegurar la verticalidad de los bordes limitantes del defecto.
De nuevo se inspecciona el hueso subcondral para descartar la comunicación con una lesión quística. Si existe una comunicación, se desbrida el quiste, eliminando, si fuera necesario, la cápsula o el revestimiento. En los defectos más profundos de la línea del hueso subcondral se utiliza injerto de esponjosa para su relleno. El autoinjerto de esponjosa se puede obtener de la tibia proximal, distal, maléolo lateral, tuberosidad del calcáneo o de la cresta iliaca. El injerto se impacta hasta el nivel del hueso subcondral. Sobre el defecto se coloca una membrana de periostio obtenida de la tibia distal y se suturan los bordes con Vicryl® 6/0. Con ayuda de la sonda de un catéter de 14 G (Gauges), se inocula bajo la membrana la suspensión de condrocitos cultivados. Finalmente, se sella la membrana de periostio con pegamento de fibrina. Se comprueba la estabilidad de la reparación moviendo completamente el tobillo en flexoextensión. La cara externa del periostio se coloca mirando al defecto osteocondral, para evitar el crecimiento del periostio hacia el lado articular. Por último, se reduce la osteotomía de tibia medial o de peroné y se fija con los tornillos correspondientes. Se cierran las incisiones por planos y se inmoviliza la articulación con una férula suropédica.
Técnica MACI
En primer tiempo de la técnica MACI es el mismo procedimiento de la técnica ACI: la evaluación artroscópica de la lesión, toma de muestra de cartílago y recortar el defecto.
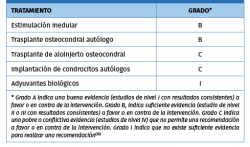
Las muestras de cartílago se envían al laboratorio. Durante 3-4 semanas se realiza la expansión de los condrocitos en monocapas. Las células cultivadas (15-20 millones de condrocitos) son inoculadas en una membrana de colágeno de tipo I/III de origen porcino.
En el segundo tiempo se accede a la articulación del tobillo a través de una osteotomía del maléolo medial o lateral bajo control de escopia. Se desbrida la lesión para asegurar un borde vertical y de cartílago sano. Los quistes subcondrales se evacuan con ayuda de una cureta. Se rellena el defecto con injerto óseo autólogo. Se mide el defecto y se utiliza una plantilla con las dimensiones del mismo. Se recorta la membrana con los condrocitos cultivados de las mismas dimensiones que el defecto para que no protruya el implante en los márgenes. Se fija la membrana con Vicryl® 6/0 y/o pegamento de fibrina. Es necesario que el lado de las células cultivadas de la membrana quede mirando al hueso subcondral. Si no existe defecto óseo, hay autores que rellenan el defecto con 2 membranas MACI, la más profunda de menor tamaño respecto a la más superficial y en medio la capa de células cultivadas. A este procedimiento se le ha denominado la “técnica sándwich”(6). La osteotomía se reduce, se fija y se inmoviliza la extremidad de forma similar a la técnica ACI descrita.
Tratamiento postoperatorio
Tras el primer tiempo artroscópico, el paciente es tratado de manera similar a la de una artroscopia estándar.
En el segundo tiempo, dependerá de si se realizó o no una osteotomía maleolar. El paciente permanece inmovilizado durante 2-6 semanas. Si la osteosíntesis de la osteotomía es estable, se puede retirar la férula y se permite al paciente realizar flexoextensión del tobillo varias veces al día. El resto del tiempo el tobillo permanece inmovilizado con ortesis de tipo Walker y sin carga del miembro afecto. Los pacientes en los que no se realizó la osteotomía pueden realizar flexoextensión de la articulación varias veces al día y el resto del tiempo el tobillo permanece inmovilizado con la ortesis de tipo Walker y sin realizar carga. A partir de la 6.ª-8.ª semana se permite al paciente comenzar con carga parcial progresiva, hasta que alcanza la carga completa. En este periodo de tiempo se le enseñan ejercicios para estimular la musculatura extrínseca y extrínseca del pie. Igualmente, se estimulan los ejercicios isométricos para mejorar la fuerza en flexión plantar y dorsal. En cuanto el paciente se maneja sin muletas y no refiere dolor, puede comenzar a conducir y se puede incorporar a un trabajo sedentario.
Durante la última fase de la rehabilitación (12-24 semanas), se estimula el fortalecimiento de la musculatura eversora del tobillo, así como el rango de movilidad en todos los planos. Comenzamos con el reentrenamiento propioceptivo y el grado de dificultad de los ejercicios se incrementa lentamente. A los 6 meses se espera que el paciente haya logrado un patrón de marcha normal sin dolor y sin bastones. En este tiempo, normalmente el paciente se ha incorporado a su actividad laboral y realiza actividades de deporte de no impacto. A los 12 meses del postoperatorio se anima a que los pacientes estén realizando todo tipo de actividades de la vida diaria, caminar en cuestas o en terreno irregular sin restricción ni dolor. De forma gradual se irán reintroduciendo actividades de mayor demanda funcional como caminar de manera intensa, correr y los deportes de recreo.
¿Qué dice la literatura?
Técnica ACI
Actualmente, los estudios de la técnica ACI pertenecen como mucho a un nivel IV de evidencia, dado que la mayoría pertenecen a series de casos clínicos.
Las diferencias en la metodología y en la variedad de la medición de los resultados a lo largo de la literatura limitan la obtención de conclusiones. De manera adicional, el no haber comparado la técnica con otras formas de manejo en estudios aleatorizados hace que no sea posible la recomendación de las técnicas de cultivo celular frente a otras alternativas de tratamiento.
Desde el punto de vista molecular, la preocupación actual es el cambio que sufren los condrocitos expandidos in vitro previo a la implantación. La diferenciación de los condrocitos en los cultivos resultan en la pérdida predominantemente del colágeno de tipo II y en la mayor formación de fibrocartílago compuesto por colágeno de tipo I(9).
La implantación de condrocitos caracterizados (con marcadores moleculares específicos) comparados con las microfracturas en un estudio aleatorizado mostró un tejido de reparación de mejor calidad a los 12 meses(9).
En línea con estos resultados, el trabajo de Guillén P et al.(10) estudió el tipo de tejido obtenido de 3 técnicas de reparación: a) perforaciones; b) células mesenquimales adultas en membrana (colágeno I/III); y c) cultivo de condrocitos autólogos en membrana. Las pruebas se efectuaron en lesiones de grado IV de rodilla de oveja. El único tratamiento que produjo cartílago hialino fue el ACI, pero en ningún caso se formó cartílago hialino con perforaciones o con implantes de células mesenquimales adultas.
Desde el punto de vista clínico, los resultados hasta ahora descritos muestran valores prometedores con tendencia en la mejoría clínica. Como se ha comentado, los resultados clínicos de la técnica ACI solo han sido publicados en series de casos(11-15).
El metaanálisis, nivel I de evidencia, de Niemeyer et al.(16) evaluó la eficacia de la técnica ACI en la reparación de LOC del astrágalo. En la revisión de 16 trabajos que cumplían los criterios de inclusión, la puntuación media de la escala de Coleman(17) fue de 65 puntos y la supervivencia clínica en general fue del 89,9%.
No se pudieron obtener resultados concluyentes por la falta de estudios control comparando la técnica ACI con otros métodos de reparación del cartílago.
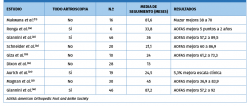
Giannini et al.(18) recogieron los resultados clínicos y de RNM de 10 pacientes a los 10 años del ACI cubierto con periostio. Los autores refieren una mejoría de la escala AOFAS (American Orthopaedic Foot and Ankle Society) de 37,9 puntos en el preoperatorio a 92,7 puntos en el postoperatorio. Se observó una completa integración del tejido regenerado y resolución de edema en 2 pacientes (20%) según los datos de imagen de la resonancia.
Battaglia et al.(19) documentaron su serie de ACI artroscópico en 20 pacientes de 35 años de edad media y un seguimiento medio de 5 años. La puntuación media de la escala AOFAS se incrementó de 59 a 84 puntos, mientras que la evaluación cuantitativa del mapeo en las secuencias T2 de RNM reveló un tejido de reparación similar al del cartílago original cubriendo un 69% del total del área del defecto.
Pradhan A, et al.(15) presentaron un trabajo comparando resultados clínicos de 51 pacientes tratados mediante técnica ACI y 9 según técnica MACI. El seguimiento medio resultó el más largo descrito: 6 años (2-12 años). La puntuación en la escala de satisfacción a largo plazo fue mejor en el grupo del ACI, con un índice de supervivencia del 91%.
Técnica MACI
Respecto a la técnica MACI, de nuevo nos encontramos con series de casos y faltan trabajos que comparen otras opciones de manejo quirúrgico(11,20-26).
De todas formas, la evidencia actual sí que sugiere una mejora en la sintomatología del paciente y unos resultados clínicos y radiográficos positivos tanto en la rodilla como en el tobillo(22,23,27).
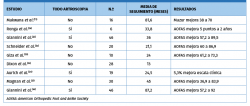
En la Tabla 2 se resumen los resultados de los estudios que emplean la técnica MACI.
El siguiente paso en la optimización de estas técnicas es eliminar uno de los 2 pasos técnicos del procedimiento y reducir así la morbilidad de la osteotomía de acceso.
Una variante todo artroscópica de la técnica MACI sustituye los puntos de sutura por un pegamento de fibrina(22). El mismo equipo(28) trató en un solo tiempo lesiones talares con aspirado concentrado de médula y una membrana de colágeno/ácido hialurónico. El estudio prospectivo demostró una mejoría en la escala AOFAS, radiológicamente y evidencia histológica de tejido de reparación en parte similar al cartílago hialino.
La serie con mayor número de pacientes corresponde a la de Kreulen C, et al.(29) con 151 biopsias y finalmente 68 pacientes en los que se realizó la técnica MACI. No se documenta el seguimiento clínico, ya que la peculiaridad del trabajo se basa en los resultados de viabilidad celular del cultivo de condrocitos obtenidos de la propia LOC del astrágalo. La técnica muestra una viabilidad de los condrocitos del 92,3% similar a la del cultivo celular de condrocitos de la rodilla.
La serie de seguimiento más larga corresponde a la publicación de Giannini et al.(30), de 46 pacientes durante 8 años, en los que se realizó una técnica MACI todo artroscópico. La media de la escala funcional AOFAS se incrementó de 57,2 puntos a 92 puntos a los 14 meses de seguimiento. Los 3 pacientes de la serie inicial(22) fueron sometidos a una segunda artroscopia con toma de biopsia. El examen histológico mostró tejido de reparación similar al del cartílago hialino.
En la serie de Magnan et al.(21) se valoraron 30 pacientes con lesiones medias de 2,36 cm2 que se trataron mediante la técnica MACI. La media de la escala AOFAS se incrementó de 36,9 a 83,9 puntos en el postoperatorio a los 45 meses. Solo un 50% de los pacientes se reincorporó a su actividad deportiva previa.
En un trabajo diferente, Quirbach et al.(31) estudiaron mediante secuencias T2 de RNM 12 pacientes sometidos a la técnica MACI. Demostraron un tejido de reparación que difería de forma significativa del grupo control sano.
Las líneas actuales de investigación se basan en modelos animales de reparación del cartílago articular que utilizan una bicapa en 3D formada por una capa de gel con condrocitos y agarosa, y otra capa inferior osteogénica con los condrocitos implantados. Este andamiaje se remodela de acuerdo a las dimensiones del defecto condral obtenidas mediante imágenes de TAC o RNM. El cultivo en un biorreactor genera carga dinámica y la diferenciación en 3D del constructo osteocondral permite su implantación directa en el defecto(32). Esta línea de investigación representa una nueva opción de tratamiento que podría resultar igualmente efectiva en humanos.
Discusión
Cada vez se incide más en la necesidad de añadir procedimientos quirúrgicos adicionales al tratamiento de las LOC sintomáticas. La mayoría de las LOC son postraumáticas y frecuentemente se acompañan de inestabilidad del tobillo o de una mala alineación del retropié. Aurich et al.(20) nos recuerdan el tratamiento concomitante de las deformidades postraumáticas (mal alineación), inestabilidades ligamentosas y la reconstrucción de los defectos óseos como actos obligatorios. Transformar una articulación con mala mecánica en una articulación casi normal biomecánicamente corrigiendo desaxaciones óseas (por ejemplo, osteotomías de calcáneo) y mejorando la estabilidad articular (reconstrucción ligamentosa lateral/medial) puede ser esencial para la cicatrización del defecto reconstruido. Por el contrario, un estrés mecánico excesivo sobre el área de tejido reparado podría eventualmente llevar al fracaso del injerto y nuevos síntomas dolorosos. Se han descrito casos de reparación ligamentosa en pacientes con LOC talares acompañadas de inestabilidad de tobillo(33,34). En la misma línea, se han publicado casos de osteotomías correctoras adicionales a la reparación osteocondral en pacientes con LOC talares acompañadas de desaxaciones(34).
A pesar de los resultados prometedores de las técnicas de implantación de condrocitos autólogos, que incluyen la mejora de la función en pacientes sometidos a una revisión, no podemos elaborar recomendaciones definitivas.
Los pacientes deberían ser asesorados correctamente con respecto a la necesidad de un procedimiento en 2 etapas y otros factores de riesgo potenciales como los asociados a la obtención del injerto de periostio.
Otro factor que puede influir en la toma de decisiones es el económico. Actualmente en España se comercializa la membrana de colágeno con condrocitos integrados en altas concentraciones. Se trata de condrocitos autólogos previamente cultivados y preparados para su implantación en el defecto condral. Su precio se estima en alrededor de los 8.000 € con la membrana incluida.
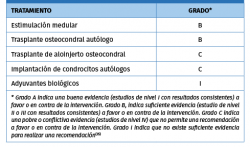
El tratamiento quirúrgico de las LOC en el astrágalo continúa siendo un tema controvertido en el ámbito internacional de la cirugía ortopédica. Dependiendo del tamaño de la lesión, tanto la estimulación de la médula ósea como el trasplante osteocondral autólogo se utilizan como opciones de tratamiento primario con buenos resultados (Tabla 3). El aloinjerto osteocondral y otras técnicas celulares pueden ser utilizadas con precaución, considerando que otras técnicas primarias han fracasado previamente.
En la Tabla 3 se resumen las técnicas de tratamiento quirúrgico de las LOC y los grados de recomendación.
De nuevo, se necesitan estudios clínicos con un buen diseño y de alta calidad metodológica para suplantar estas directrices clínicas.
Conclusiones
El tratamiento de las LOC sintomáticas del astrágalo presenta dificultades y limitaciones debidas a una pobre regeneración del cartílago articular y un acceso limitado a la articulación del tobillo.
Los resultados clínicos de los cultivos celulares y de la tecnología de los bioinjertos, aunque están limitados a estudios de series de casos, son sin duda alentadores. Actualmente, los resultados muestran una mejora de las escalas funcionales tras el tratamiento con la técnica MACI.
El desarrollo de las técnicas de reparación de las lesiones “todo artroscópico” y la posibilidad de cultivar células a partir de líneas de células madre probablemente mitigarán la morbilidad de la osteotomía y potencialmente harán de la técnica MACI un tratamiento en un solo tiempo.
Es importante que el cirujano comprenda las causas del fracaso, así como los múltiples factores que influyen en los resultados artroscópicos del tratamiento de las LOC. La presencia de estos factores de riesgo debe estimular a los cirujanos en la búsqueda de nuevas estrategias de tratamiento, así como un asesoramiento individualizado de cada paciente.
Figuras
Figura 1. Escalera de tratamiento en las lesiones osteocondrales (LOC) del astrágalo. ACI: autologous chondrocyte implantation; MACI: membrane autologous chondrocyte implantation.
Tablas
Cita bibliográfica
Autores
Pilar Martínez de Albornoz Torrente
Unidad de Cirugía de Pie y Tobillo, Cirugía Ortopédica y Traumatología, Hospital Universitario Quirónsalud Madrid. IOTAM.
Facultad de Medicina, Universidad Europea, Madrid
Referencias bibliográficas
-
1Triche R, Mandelbaum BR. Overview of cartilage biology and new trends in cartilage stimulation. Foot Ankle Clin. 2013;18(1):1-12.
-
2Chuckpaiwong B, Berkson EM, Theodore GH. Microfracture for osteochondral lesions of the ankle: outcome analysis and outcome predictors of 105 cases. Arthroscopy. 2008;24(1):106-12.
-
3Paul J, Sagstetter M, Lämmle L, Spang J, El-Azab H, Imhoff AB, Hinterwimmer S. Sports activity after osteochondral transplantation of the talus. Am J Sports Med. 2012;40(4):870-4.
-
4Imhoff AB, Paul J, Ottinger B, Wörtler K, Lämmle L, Spang J, Hinterwimmer S. Osteochondral transplantation of the talus: long-term clinical and magnetic resonance imaging evaluation. Am J Sports Med. 2011;39(7):1487-93.
-
5Brittberg M, Lindahl A, Nilsson A, Ohlsson C, Isaksson O, Peterson L. Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation. N Engl J Med. 1994;331(14):889-95.
-
6Johnson B, Lever C, Roberts S, Richardson J, McCarthy H, Harrison P, et al. Cell cultured chondrocyte implantation and scaffold techniques for osteochondral talar lesions. Foot Ankle Clin. 2013;18(1):135-50.
-
7Harrison PE, Ashton IK, Johnson WE, Turner SL, Richardson JB, Ashton BA. The in vitro growth of human chondrocytes. Cell Tissue Bank. 2000;1(4):255-60.
-
8Nam EK, Ferkel RD, Applegate GR. Autologous chondrocyte implantation of the ankle: a 2- to 5-year follow-up. Am J Sports Med. 2009;37(2):274-84.
-
9Saris DB, Vanlauwe J, Victor J, Haspl M, Bohnsack M, Fortems Y, et al. Characterized chondrocyte implantation results in better structural repair when treating symptomatic cartilage defects of the knee in a randomized controlled trial versus microfracture. Am J Sports Med. 2008;36(2):235-46.
-
10Guillén P, Rodríguez-Iñigo E, Guillén I. Increasing the dose of autologous chondrocytes improves articular cartilage repair: Histological and molecular study in the sheep. Animal model. Cartilage. 2013;XX:1-9.
-
11Whittaker JP, Smith G, Makwana N, Roberts S, Harrison PE, Laing P, Richardson JB. Early results of autologous chondrocyte implantation in the talus. J Bone Joint Surg Br. 2005;87(2):179-83.
-
12Baums MH, Heidrich G, Schultz W, Steckel H, Kahl E, Klinger HM. Autologous chondrocyte transplantation for treating cartilage defects of the talus. J Bone Joint Surg Am. 2006;88(2):303-8.
-
13Baums MH, Heidrich G, Schultz W, Steckel H, Kahl E, Klinger HM. The surgical technique of autologous chondrocyte transplantation of the talus with use of a periosteal graft. Surgical technique. J Bone Joint Surg Am. 2007;89 Suppl 2 Pt.2:170-82.
-
14Giannini S, Vannini F, Buda R. Osteoarticular grafts in the treatment of OCD of the talus: mosaicplasty versus autologous chondrocyte transplantation. Foot Ankle Clin. 2002;7(3):621-33. Review.
-
15Pradhan A, et al. Paper #509. Presented at: British Orthopaedic Association Annual Congress. Sept. 13-16, 2016; Belfast, Northern Ireland.
-
16Niemeyer P, Salzmann G, Schmal H, Mayr H, Südkamp NP. Autologous chondrocyte implantation for the treatment of chondral and osteochondral defects of the talus: a meta-analysis of available evidence. Knee Surg Sports Traumatol Arthrosc. 2012;20(9):1696-703.
-
17Jakobsen RB, Engebretsen L, Slauterbeck JR. An analysis of the quality of cartilage repair studies. J Bone Joint Surg Am. 2005;87(10):2232-9. Review.
-
18Giannini S, Buda R, Grigolo B, Vannini F. Autologous chondrocyte transplantation in osteochondral lesions of the ankle joint. Foot Ankle Int. 2001;22(6): 513-7.
-
19Battaglia M, Vannini F, Buda R, Cavallo M, Ruffilli A, Monti C, et al. Arthroscopic autologous chondrocyte implantation in osteochondral lesions of the talus: mid-term T2-mapping MRI evaluation. Knee Surg Sports Traumatol Arthrosc. 2011;19(8):1376-84.
-
20Aurich M, Bedi HS, Smith PJ, Rolauffs B, Mückley T, Clayton J, Blackney M. Arthroscopic treatment of osteochondral lesions of the ankle with matrix-associated chondrocyte implantation: early clinical and magnetic resonance imaging results. Am J Sports Med. 2011;39(2): 311-9.
-
21Magnan B, Samaila E, Bondi M, Vecchini E, Micheloni GM, Bartolozzi P. Three-dimensional matrix-induced autologous chondrocytes implantation for osteochondral lesions of the talus: midterm results. Adv Orthop. 2012:942174.
-
22Giannini S, Buda R, Vannini F, Di Caprio F, Grigolo B. Arthroscopic autologous chondrocyte implantation in osteochondral lesions of the talus: surgical technique and results. Am J Sports Med. 2008;36(5):873-980.
-
23Giza E, Sullivan M, Ocel D, Lundeen G, Mitchell ME, Veris L, Walton J. Matrix-induced autologous chondrocyte implantation of talus articular defects. Foot Ankle Int. 2010;31(9):747-53.
-
24Schneider TE, Karaikudi S. Matrix-Induced Autologous Chondrocyte Implantation (MACI) grafting for osteochondral lesions of the talus. Foot Ankle Int. 2009;30(9): 810-4.
-
25Dixon S, Harvey L, Baddour E, Janes G, Hardisty G. Functional outcome of matrix-associated autologous chondrocyte implantation in the ankle. Foot Ankle Int. 2011;32(4): 368-74.
-
26Ronga M, Grassi FA, Montoli C, Bulgheroni P, Genovese E, Cherubino P. Treatment of deep cartilage defects of the ankle with matrix-induced autologous chondrocyte implantation (MACI). Foot Ankle Surg. 2005;11(1):29-33.
-
27Filardo G, Kon E, Di Martino A, Iacono F, Marcacci M. Arthroscopic second-generation autologous chondrocyte implantation: a prospective 7-year follow-up study. Am J Sports Med. 2011;39(10):2153-60.
-
28Giannini S, Buda R, Vannini F, Cavallo M, Grigolo B. One-step bone marrow-derived cell transplantation in talar osteochondral lesions. Clin Orthop Relat Res. 2009;467(12):3307-20.
-
29Kreulen C, Giza E, Kim J, Campanelli V, Sullivan M. Viability of talus osteochondral defect cartilage for chondrocyte harvesting: results of 151 patients. Foot Ankle Int. 2014;35(4):341-5.
-
30Giannini S, Buda R, Ruffilli A, Cavallo M, Pagliazzi G, Bulzamini MC, et al. Arthroscopic autologous chondrocyte implantation in the ankle joint. Knee Surg Sports Traumatol Arthrosc. 2014;22(6):1311-9.
-
31Quirbach S, Trattnig S, Marlovits S, Zimmermann V, Domayer S, Dorotka R, et al. Initial results of in vivo high-resolution morphological and biochemical cartilage imaging of patients after matrix-associated autologous chondrocyte transplantation (MACT) of the ankle. Skeletal Radiol. 2009;38(8):751-60.
-
32Cook JL. Tissue engineering approaches to cartilage repair in AOFAS. San Diego (CA); 2012.
-
33Kono M, Takao M, Naito K, Uchio Y, Ochi M. Retrograde drilling for osteochondral lesions of the talar dome. Am J Sports Med. 2006;34(9):1450-6.
-
34Giannini S, Buda R, Faldini C, Vannini F, Bevoni R, Grandi G, et al. Surgical treatment of osteochondral lesions of the talus in young active patients. J Bone Joint Surg Am. 2005;87 Suppl 2:28-41.
-
35Wright JG, Einhorn TA, Heckman JD. Grades of recommendation. J Bone Joint Surg Am. 2005;87(9):1909-10.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Introducción
- Derivados hematológicos: plasma rico en plaquetas (PRP)
- Viscosuplementación en el pie y el tobillo
- ACI/MACI
- Geles y membranas
- Injerto autólogo
- Sustitutivos óseos
- Radiofrecuencia
- Electrólisis percutánea intratisular (EPI®)
- Utilidad del ozono para terapia en cirugía ortopédica
- Conclusiones
Más en PUBMED
Más en Google Scholar


La Monografía de Actualización de la SEMCPT está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.