Una nueva técnica artroscópica de implante de condrocitos autólogos en matriz encapsulada (ICAME) en patela: evaluación clínica y por mapeo T2 a 4 años de seguimiento
A new arthroscopic technique of matrix-encapsulated autologous chondrocyte implantation (MEACI) in patella: clinical and T2 mapping evaluation at 4 years of follow-up
Resumen:
Propósito: evaluar los resultados clínicos y por imagen (mapeo T2) del implante artroscópico de condrocitos autólogos en matriz encapsulada (ICAME) en lesiones condrales en patela a un seguimiento de 4 años.
Métodos: se incluyeron 16 pacientes de 18 a 55 años de edad (promedio 34,37 ± 2,59) con lesión(es) condral(es) focalizadas en patela. Se les realizó el ICAME mediante artroscopia y en algunos casos se adicionó alguna de las técnicas de realineación o descompresión patelofemoral. El seguimiento clínico se evaluó mediante escalas de rodilla y la calidad del tejido de reparación se cuantificó por mapeo T2 comparándose con una zona de cartílago sano adyacente.
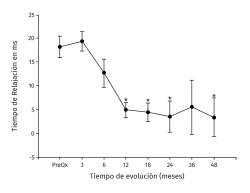
Resultados: el tiempo de relajación del tejido de reparación (ROI-6, 54,81 ± 7,07) fue significativamente mayor al del cartílago control (ROI-3, 35,44 ± 5,51) a los 3 meses de postoperados (p < 0,001). A los 18 meses dichos valores disminuyeron sin observarse diferencia significativa entre el control (34,42 ± 3,66) y la zona de reparación (38,80 ± 6,71) (p = 0,0863) manteniéndose estable hasta los 48 meses de seguimiento (ROI-3, 34,80 ± 4,81 vs. ROI‑6 38,16 ± 6,23) (p = 0,367). Clínicamente hubo una mejoría significativa en las escalas posquirúrgicas a 48 meses comparadas con los valores antes de la cirugía, respectivamente (Lysholm: 85,50 ± 13,72 vs. 57,47 ± 23,33 –p < 0,001–; Kujala: 88,00 ± 5,00 vs. 54,60 ± 11,07 –p < 0,001–; Tegner: 5,75 ± 2,06 vs. 2,53 ± 0,42 –p = 0,001–; IKDC: 71,95 ± 9,44 vs. 43,37 ± 2,85 –p < 0,001). No se reportaron fallas.
Conclusión: la técnica artroscópica del ICAME en patela mostró una mejoría clínica significativa a los 48 meses de seguimiento y el tejido de reparación evaluado por mapeo T2 demostró una calidad similar al cartílago nativo que se mantiene a los 48 meses del implante.
Nivel de evidencia: IV, serie de casos.
Abstract:
Purpose: to evaluate clinical and imaging (T2 mapping) outcomes of the arthroscopic technique of matrix-encapsulated autologous chondrocytes implantation (MEACI) in chondral lesions in patella at a follow-up of 4 years.
Methods: we included 16 patients aged 18 to 55 years old (average 34.37 ± 2.59) with chondral lesion(s) localized in the patella. They underwent the arthroscopic technique of MEACI and in some cases techniques of patellofemoral realignment or decompression. Clinical follow-up was assessed using knee scores and repair tissue quality was quantified by T2-Mapping and comparing to an adjacent zone of native cartilage.
Results: repair tissue relaxation time (ROI-6, 54.81 ± 7.07) was significantly higher than that of the control cartilage (ROI-3, 35.44 ± 5.51) at 3 months postoperatively (p < 0.001). At 18 months, these values decreased without a significant difference between control (34.42 ± 3.66) and the repaired zone (38.80 ± 6.71) (p = 0.0863), remaining stable until 48 months of follow-up (ROI-3 34.80 ± 4.81 vs. ROI-6 38.16 ± 6.23, p = 0.367). Clinically there was a significant improvement in the post-surgical scores at 48 months compared with values before surgery, respectively (Lysholm: 85.50 ± 13.72 vs. 57.47 ± 23.33 –p <0.001–; Kujala: 88.00 ± 5.00 vs. 54.60 ± 11.07 –p <0.001–; Tegner: 5.75 ± 2.06 vs. 2.53 ± 0.42 –p = 0.001–; IKDC: 71.95 ± 9.44 vs. 43.37 ± 2.85 –p < 0.001–). Failures were not observed.
Conclusion: the arthroscopic technique of MEACI in patella showed a significant clinical improvement at 48 months of follow-up and repaired tissue evaluated by T2 mapping demonstrated a similar quality to the native cartilage that is maintained at 48 months after implantation.
Level of evidence: IV, series of cases.
Introducción
Las lesiones de cartílago en patela son frecuentes en las artroscopias de rodilla; Curl et al.(1) han reportado que de las lesiones condrales de grado III la patela es la localización más común. En las lesiones condrales de grado IV la patela ocupa la segunda localización en frecuencia, precedida por las lesiones de cartílago en el cóndilo femoral medial. Widuchowski et al.(2) han descrito que la patela es la principal localización de lesiones condrales observadas durante alguna artroscopia en un 36% de los casos seguida del cóndilo femoral medial en el 34% de los casos. La capacidad de curación espontánea del cartílago es muy baja(3) debido a la poca vascularidad con la que cuenta, así como la complejidad de las fuerzas de compresión y cizallamiento que actúan sobre ella para permitir su movilidad axial(4) durante la flexoextensión de la rodilla. Sumado a esto se encuentran patologías no diagnosticadas previamente que dificultan el manejo de las lesiones condrales de patela, como son la mala alineación o hiperpresión patelofemoral, la inestabilidad de patela o la displasia troclear(5). Todos estos factores sumados contribuyen al dolor anterior de la rodilla y este resulta ser limitante para las actividades de la vida diaria, además de que condiciona artrosis temprana(3,6).
El tratamiento de las lesiones condrales en patela suele ser difícil y controvertido. Dentro de las opciones disponibles se encuentran las microfracturas(7,8,9), las cuales tienen la desventaja de ser un procedimiento técnicamente difícil por el ángulo de visualización y el acceso a las lesiones condrales en patela(10); además, el hecho de utilizar un microfracturador angulado no permite la transmisión de las cargas adecuadamente para llegar al hueso subcondral, reportándose tasas de revisión de hasta un 31% a 5 años(9). El traslado osteocondral también resulta ser una técnica difícil en patela, ya que conlleva en primera instancia realizar una artrotomía y liberación retinacular para evertir la patela y acceder a la superficie articular(11), además de que el autoinjerto femoral es estructuralmente diferente del cartílago patelar nativo adyacente, por lo que no suele otorgar adecuada congruencia(10), además de ocasionar una alta tasa de rigidez postoperatoria.
En la actualidad existen múltiples técnicas descritas de implante de condrocitos autólogos(5,6,12,13,14,15) con resultados satisfactorios a corto y mediano plazo; sin embargo, estas técnicas descritas conllevan a la necesidad de una artrotomía o miniartrotomía asistida con artroscopia para tener un mejor acceso a la lesión. En el ámbito de la cirugía artroscópica, solo existe una técnica reportada en la literatura en la cual R. Siebold et al.(16) describen la realización del procedimiento en decúbito prono, en el cual vierten microesferas de condrocitos hasta la adhesión de estas favorecida por la posición, lo cual lo vuelve una técnica compleja si se requiere la realización de cirugías adicionales para el manejo de lesiones concomitantes como osteotomías de la tuberosidad anterior de la tibia, reparación de meniscos, reconstrucción de ligamentos cruzados o el implante de condrocitos en tróclea y/o cóndilos, ya que se requiere cambiar la posición a decúbito supino para dichos procedimientos. El propósito del siguiente estudio es demostrar la efectividad clínica y por imagen del implante artroscópico de condrocitos autólogos en matriz encapsulada (ICAME) en lesiones condrales de patela a 4 años de seguimiento.
Material y métodos
Se incluyeron pacientes de 18 a 55 años de edad, de ambos géneros, con al menos una o varias lesiones condrales focalizadas en patela de grado III o IV (International Cartilage Repair Society, ICRS), con o sin hiperpresión lateral o mala alineación patelofemoral. Los pacientes fueron tratados con la técnica artroscópica de ICAME de 2010 a 2016 previa firma del consentimiento informado. El proyecto fue sometido a valoración y aprobado por el comité de ética institucional (Registro INR 01/11). Se realizó evaluación clínica y de imagen de todos los pacientes antes de la cirugía y posteriormente a los 3, 6, 9, 12, 24, 36 y 48 meses del implante. El procedimiento quirúrgico consistió en 2 tiempos quirúrgicos, ambos completamente artroscópicos. El primer tiempo quirúrgico para la toma de biopsia y, aproximadamente 6 semanas después, el segundo tiempo quirúrgico consistente en el implante de los condrocitos expandidos.
Primera cirugía: toma de biopsia y manejo de lesiones concomitantes
Durante el primer tiempo quirúrgico se realizaron los procedimientos quirúrgicos necesarios, previa valoración de estudios de imagen y planificación quirúrgica, para lograr una adecuada alineación patelofemoral y disminuir zonas de hiperpresión a nivel del o los defectos condrales a tratar en patela, así como para tratar las lesiones concomitantes de menisco o ligamento cruzado anterior (LCA).
Asimismo, bajo la técnica previamente reportada por Masri et al.(17), se realizó el procedimiento de toma de biopsia de 3 taquetes osteocondrales de una zona de “no carga” adyacente a la escotadura con diámetro de 4 mm y profundidad de 10 mm utilizando un sistema COR® (DePuy Mitek, Raynham, MA). Los taquetes se colocaron en un tubo estéril con medio de cultivo DMEM/F12® (Gibco Grand Island, NY) suplementado con antibiótico/antimicótico con 1.000 unidades/mL de penicilina, 1.000 µg/mL de estreptomicina y 2,5 µg/mL de antimicótico Fungizone® (Gibco Grand Island, NY) y se trasladaron al laboratorio de biotecnología para el aislamiento de los condrocitos.
Aislamiento de los condrocitos
Bajo condiciones estériles, en una campana de flujo laminar se separó el cartílago del hueso con bisturí. El cartílago se fragmentó y posteriormente se sometió a digestión enzimática con Colagenasa de tipo II CLS2® (Wortinthong Biochemical Corp. Lakewood, NJ) durante un promedio de 4 a 5 horas a 37 °C bajo agitación continua (aproximadamente 200 rpm) para disgregar el tejido y aislar los condrocitos. Al término se realizó el conteo de los condrocitos y se evaluó la viabilidad por exclusión mediante la tinción con azul de tripano al 0,4% (Gibco, Grand Island, NY) en cámara de Neubauer. Posteriormente se sembraron en una caja de cultivo T-25® (Falcon Primaria, USA Cal) a una densidad de 10.000 células por cm2 adicionadas con medio de cultivo DMEM/F12® (Dulbecco’s Modified Eagle Medium-F12 GIBCO, Grand Island, NY) y suplementado con antibiótico con 100 unidades/mL de penicilina, 100 µg/mL de estreptomicina y 0,25 µg/mL de antimicótico Fungizone® (Gibco Grand Island, NY) y 10% de suero autólogo previamente tomado, descomplementado y filtrado a 0,22 µm. Los condrocitos se expandieron hasta llegar a una confluencia mínima del 90% (es decir, que al menos el 90% del perímetro de cada célula se encuentra en contacto con otra célula) y luego se tripsinizaron y se volvieron a sembrar (pase 1) a una densidad de 20.000 células por cm2 para la expansión celular, repitiendo el procedimiento hasta el pase 2. Al inicio del segundo pase, el 33% de las células se sembraron en cajas T75 con medio DMEM/F12® antibiótico antimicótico y suero autólogo al 10% y suplementados con ácido ascórbico 60 µg/mL (Sigma Aldrich USA), para inducir la secreción de colágena y formación de una monocapa. El restante de las células se resembraron en cajas T75® bajo las mismas condiciones.
Formación del constructo
Una vez alcanzada la monocapa una confluencia del 90 al 100%, esta fue despegada de la caja encima de la cual se colocó un fragmento de 8 mm de diámetro de un andamio de ácido poliglicólico Alpha Chondro Shield® (Alpha Research, Switerland) y, sobre este, un pellet de condrocitos obtenidos de las cajas T75® como se describió por Masri et al.(17). El constructo se dejó en cultivo por una semana para facilitar la adherencia de los condrocitos al andamio, para posteriormente ser implantado.
Segunda cirugía: implante artroscópico de condrocitos en patela
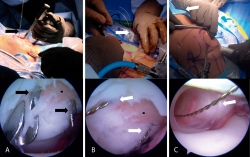
Todos los procedimientos se realizaron bajo efectos de bloqueo peridural; la técnica se realizó en decúbito supino. Se realizaron portales artroscópicos estándar a la rodilla (anterolateral y anteromedial). Una vez realizado el recorrido artroscópico, se desbridó la zona del defecto condral retirando la capa calcificada de hueso subcondral con una legra artroscópica; asimismo, se retiraron los bordes hasta dejarla contenida y con paredes estables de cartílago sano. Posteriormente, se midió la lesión y se determinó la cantidad de constructos a implantar calculando un implante por cada cm2 sin sobredimensionar el implante (dejando en caso necesario un espacio máximo de 2 mm entre cada implante). A través del portal de mejor acceso a la zona de la lesión (portal anterolateral o anteromedial) se introdujo una guía tibial para la reconstrucción del LCA (Figura 1A) con la cual se perforaron 2 túneles a través de la patela entrando por la cortical y saliendo intraarticular justo en la zona del defecto. Las perforaciones se realizaron con clavillos de Kirschner 0,062 dejando 3 a 5 mm de separación entre cada uno, siendo el punto intermedio de las 2 perforaciones el centro de la lesión. Posteriormente, se realizó una incisión en la piel de la región anterior de la patela de aproximadamente 15 mm para identificar la entrada de los clavillos en la cortical anterior de la patela. Los clavillos se removieron y en el orificio realizado se introdujo un alambre pasa suturas (CHIA PERCPASSER®, Suture Passer Depuy Synthes Mitek, Raynham, MA) (Figura 1B) desde la cortical anterior de la patela e introduciéndolo a la articulación para ser recuperado por alguno de los portales (Figura 1C).
figura1.jpg
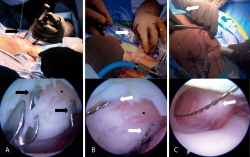
Figura 1. Técnica de implante artroscópico en patela. A: en la parte superior se muestra una vista externa de la colocación de la guía del ligamento cruzado anterior (LCA); se aprecia un clavillo de Kirschner 0,062 previamente colocado. En la parte inferior se muestra una vista artroscópica por el portal anterolateral de la lesión condral previamente desbridada y la entrada de los 2 clavillos de Kirschner 0,062 equidistantes al centro de la lesión; B: en la parte superior se observan los alambres pasasuturas colocados a través de los túneles realizados mediante los clavillos de Kisrchner, los cuales previamente se retiraron para introducir los alambres pasasuturas. Abajo se muestra la misma vista artroscópica de la lesión una vez cambiados los clavillos de Kirschner por los alambres pasasuturas; C: en la parte superior se observa la introducción de la cánula de 10 mm, la cual en este caso se realiza a través del portal anteromedial. Abajo se muestra una vista artroscópica de la cánula ya introducida por la cual se ha recuperado el extremo articular de los alambres pasasuturas y se han llevado al exterior a través de la cánula. Las flechas negras señalan los clavillos de Kirschner 0,062, las flechas blancas señalan las agujas pasasuturas y los puntos negros indican el centro geométrico de la lesión condral.
En una mesa de quirófano (separada) vestida en forma estéril se recibió, con técnica aséptica por parte del personal de laboratorio, el constructo de condrocitos en matriz encapsulados, en forma de un disco circular de aproximadamente 8-10 mm de diámetro y una altura de 5-6 mm.
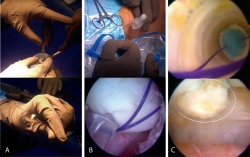
Se perforó el constructo con 2 agujas hipodérmicas (20 G × 32 mm) equidistantes al centro geométrico de este y se le colocó una sutura PDS del # 0, (la cual se pasó en 2 ocasiones) pasando los extremos de la sutura a través de las agujas que perforaron el constructo, dejando los 2 cabos libres de sutura del lado de la cara del constructo que tiene la base de polímero, la cual deseamos haga contacto directo con el hueso subcondral de la lesión a reparar (Figura 2A). A través de una cánula transparente de 10 mm de diámetro colocada en el portal que mejor dirección otorga a la lesión, se introdujo el constructo al introducir los 2 cabos del PDS en el ojal de cada alambre pasasuturas, haciendo tracción de estos desde la cortical anterior de la patela para recuperar el extremo libre de la sutura (Figura 2B) y, posteriormente, realizando tracción de la sutura para asentar el implante justo en el fondo de la lesión (Figura 2C) y anudando la sutura PDS en la cortical anterior de la patela, fijando así el implante. En caso de necesitar más de un implante se repitió el mismo procedimiento antes descrito hasta cubrir el área del defecto en su totalidad con los constructos.
Una vez colocados todos los implantes se realizó flexoextensión de la rodilla para verificar la estabilidad del implante.
figura2.jpg
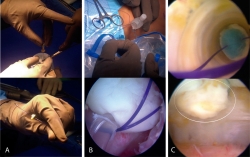
Figura 2. Técnica de implante artroscópico en patela. A: en la parte superior se muestra el implante siendo perforado con aguja hipodérmica para pasar la sutura PDS del lado que contacta con la superficie ósea al lado articular y de nuevo al lado que contacta con la superficie ósea. Abajo se muestra cómo queda el implante una vez pasada la sutura; B: en la parte superior se muestra cómo se introducen los extremos libres de la sutura PDS en el ojal de los alambres pasasuturas, los cuales al traccionar permiten recuperar los extremos de la sutura a través del abordaje anterior. Abajo se muestra una vista artroscópica en la cual la sutura PDS ya se ha recuperado por el abordaje anterior; C: en la parte superior se muestra una vista artroscópica dirigida a través de la cánula de 10 mm en la que se observa cómo el implante desciende al traccionar la sutura PDS. En la parte inferior de muestra el implante situado y cubriendo el sitio de la lesión. La línea blanca delimita el implante.
figura2.jpg

Figura 2. Técnica de implante artroscópico en patela. A: en la parte superior se muestra el implante siendo perforado con aguja hipodérmica para pasar la sutura PDS del lado que contacta con la superficie ósea al lado articular y de nuevo al lado que contacta con la superficie ósea. Abajo se muestra cómo queda el implante una vez pasada la sutura; B: en la parte superior se muestra cómo se introducen los extremos libres de la sutura PDS en el ojal de los alambres pasasuturas, los cuales al traccionar permiten recuperar los extremos de la sutura a través del abordaje anterior. Abajo se muestra una vista artroscópica en la cual la sutura PDS ya se ha recuperado por el abordaje anterior; C: en la parte superior se muestra una vista artroscópica dirigida a través de la cánula de 10 mm en la que se observa cómo el implante desciende al traccionar la sutura PDS. En la parte inferior de muestra el implante situado y cubriendo el sitio de la lesión. La línea blanca delimita el implante.
Rehabilitación postoperatoria
Se inició terapia de rehabilitación temprana intrahospitalaria iniciando con crioterapia y movilización pasiva asistida continua por 6 a 8 horas diarias limitando los arcos de movilidad de 0 a 30° durante 2 semanas y posteriormente incrementando 30° por semana hasta completar los arcos de movilidad. El apoyo se difirió por 6 semanas; al cumplir 12 semanas de postoperados los pacientes se enrolaron a un protocolo institucional de 27 sesiones de ejercicios de fortalecimiento de cadena abierta previa valoración isocinética hasta lograr una fuerza flexora y extensora mínima del 80% de la fuerza de la pierna contralateral. En caso necesario, se requirieron sesiones extras.
Evaluación clínica
Se realizaron evaluaciones clínicas antes del implante y a los 3, 6, 9, 12, 18, 24, 36 y 48 meses postoperatorios con la aplicación de escalas validadas de rodilla: Lysholm, Tegner, Kujala e IKDC (International Knee Documentation Committee).
Evaluación de la calidad del tejido de reparación: mapeo en T2
Realizamos mapeo T2 previo a la cirugía y a los 3, 6, 12, 18, 24, 36 y 48 meses postoperatorios usando un resonador de 1,5 teslas (GE Healthcare, Milwaukee WI) utilizando software apropiado para el procedimiento de imágenes (FuncTool 4.5.1, GE Healthcare, Little Chalfont, Buckinghamshire, UK). Realizamos valoración morfológica y cuantitativa a través de la medición de un área de 4 mm2 del cartílago nativo adyacente al implante (ROI-3) y una medición de 4 mm2 de la zona reparada (ROI-6).
Segunda vista artroscópica
Se realizó una segunda vista artroscópica 1 año posterior a la cirugía de implante a los pacientes que bajo libre albedrío y sin ningún tipo de presión aceptaron someterse a dicho procedimiento, previa firma del consentimiento informado. Los vídeos de las cirugías fueron observados por 3 cirujanos experimentados en artroscopia de rodilla y cada uno realizó por separado una evaluación de la calidad del tejido reparado usando la escala especializada de la ICRS. Se obtuvo el promedio de las 3 evaluaciones para cada paciente.
Análisis estadístico
Los valores se expresan como el promedio y la derivación estándar (DE). Los datos cualitativos se expresan como valores absolutos o porcentajes. Se realizó prueba de rangos signados de Wilcoxon para comparar los valores clínicos y por mapeo T2 a través del tiempo comparando con el antes y el después. Se compararon los valores de mapeo en T2 en cartílago nativo e implante; utilizamos una Prueba t de Student no pareada previa aprobación del test de normalidad de Shapiro-Wilk. Los valores de Tegner no presentaron distribución normal, por lo que se realizó prueba de suma de rangos de Mann-Whitney para compararlos. Los datos se analizaron mediante el software SigmaPlot 12.3 para Windows. Se consideró como significación estadística p < 0,05.
Resultados
Resultados demográficos
Se incluyeron un total de 16 pacientes con una edad promedio de 34,37 años (DE ± 2,59) de los cuales 8 fueron hombres y 8 mujeres. Se repararon un total de 18 lesiones con la siguiente localización: 13 en faceta lateral, 2 en faceta medial y 4 en cresta de patela. Según el lado intervenido, 9 rodillas fueron derechas y 7 izquierdas. El tamaño promedio de la lesión fue de 1,28 cm2 (DE ± 0,48), siendo la lesión más pequeña de 1 cm2 y la más grande de 3 cm2. A 3 pacientes se les realizó liberación del retináculo lateral y plicatura medial como procedimiento concomitante, a un paciente se le realizó osteotomía de la tuberosidad anterior de la tibia de tipo Fulkerson al momento de la toma de biopsia, 2 pacientes tuvieron un procedimiento previo de reconstrucción del LCA y remodelación o reparación meniscal. El seguimiento promedio de los pacientes fue de 48,24 meses (DE ± 6,05).
Evaluación clínica
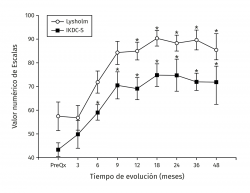
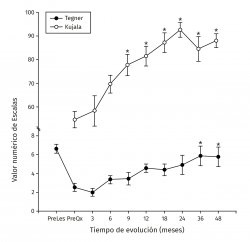
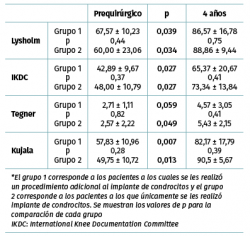
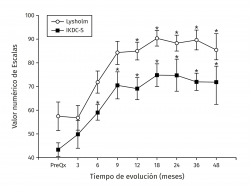
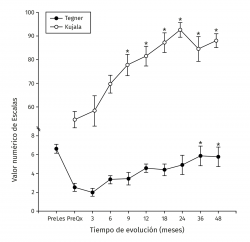
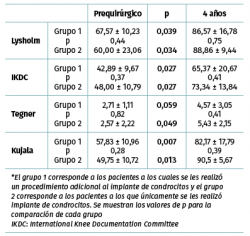
Los valores de Lysholm prequirúrgicos fueron de 57,47 ± 23,33, ascendiendo progresivamente hasta alcanzar a los 12 meses un valor de 85 ± 12,53 con diferencia significativa (p < 0,001) la cual se mantiene hasta los 48 meses con valor de 85,50 ± 13,72 (p < 0,001). Los valores de IKDC subjetivo prequirúrgicos fueron de 43,37 ± 2,85 ascendiendo a 70,53 ± 5,75 a los 9 meses (p < 0,001) manteniéndose hasta los 48 meses con valor de 71,95 ± 9,45 (p < 0,001) (Figura 3). La escala funcional de Tegner presentó valores referidos previos a la lesión de 6,6 ± 0,48, disminuyendo posterior a la lesión y antes del implante a 2,53 ± 0,42, ascendiendo a valores de 5,83 ± 1,05 a los 36 meses y a 5,75 ± 2,06 a los 48 meses (p < 0,001). Los valores prequirúrgicos de Kujala fueron de 54,60 ± 11,07, ascendiendo a 77,66 ± 4,48 a los 9 meses (p < 0,001) y continúan ascendiendo a 88,00 ± 5,00 a los 48 meses (p < 0,001) (Figura 4). Para comparar el efecto de los procedimientos adicionales realizados previamente (reparación del LCA) o como tratamiento concomitante (osteotomía de anteromedialización o liberación del retináculo lateral), dividimos a los pacientes en 2 grupos: un grupo de pacientes a los que se les realizó el implante de condrocitos y algún procedimiento adicional (grupo 1) y un grupo de pacientes al que únicamente se les realizó el implante de condrocitos (grupo 2). En la Tabla 1 se muestran los valores de escalas clínicas por grupo. Se observa mejoría de los valores prequirúrgicos a los 4 años en todos los casos a excepción del valor de Tegner en el grupo 1. A pesar de que los valores a 4 años fueron mejores en el grupo 2, no se encontraron diferencias significativas en ninguno de los casos.
Evaluación por imagen de la calidad del tejido de reparación
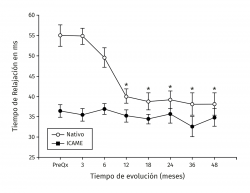
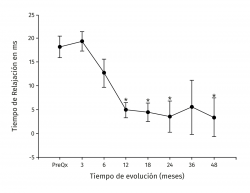
Los valores del tiempo de relajación del agua en milisegundos se mantuvieron sin cambios a lo largo del seguimiento para el tejido nativo. La zona de lesión condral tuvo valores prequirúrgicos de 54,99 ± 6,43 en contraste con 36,38 ± 4 para el tejido nativo (p < 0,001), a los 3 meses fueron 35,44 ± 5,51 para el tejido nativo vs. 54,81 ± 7,07 para el implante (p < 0,001) y fueron disminuyendo hasta equipararse a los 18 meses con valores de 34,42 ± 3,66 para el tejido nativo vs. 38,80 ± 6,71 para el implante (p = 0,0863), manteniéndose hasta los 48 meses con valores de 34,80 ± 4,81 para el tejido nativo vs. 38,16 ± 6,23 para el implante (p = 0,367). Hubo mejoría de los valores del implante a partir de los 12 meses 40,05 ± 6,7 y hasta los 48 meses (38,17 ± 6,23) con respecto al valor prequirúrgico del mismo (54,99 ± 6,43) y de 3 meses (54,81 ± 7,07) (p < 0,001) (Figura 5). La diferencia del tiempo de relajación del agua en milisegundos del implante con su respectivo control de tejido nativo fue de 18,2 ± 5,63 prequirúrgico, de 19,37 ± 7,41 a los 3 meses y desciende progresivamente hasta valores de 3,37 ± 4,12 a los 48 meses (p < 0,001) (Figura 6). Los valores obtenidos al dividir por grupos fueron de 54,97 ± 7,36 para la zona de lesión previa al implante para el grupo 1, disminuyendo a los 4 años a valores de 38,13 ± 8,02 (p = 0,015) para la zona implantada; y para el grupo 2 fueron de 55,01 ± 7,02 para la zona de lesión y de 37,07 ± 8,25 (p = 0,027) para el implante a los 4 años. No hubo diferencia entre los valores de los 2 grupos previos a la cirugía o a los 4 años de seguimiento.
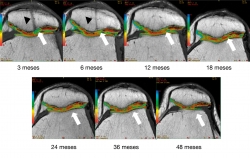
Los cambios morfológicos subjetivos se aprecian a partir de los 12 meses: en la escala se asignó al color azul al valor de 95 ms y al rojo al valor de 25 ms; la coloración tiene una tendencia al verde-azul y progresivamente cambia al rojo-naranja, que es la que muestra el cartílago nativo. En la Figura 7 se aprecia un ejemplo del seguimiento por mapeo en T2. Al comparar el implante con el tejido nativo se aprecia cómo a partir de los 12 meses se parece al cartílago nativo.
figura5.png
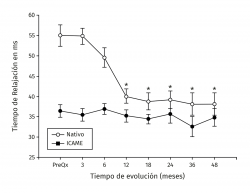
Figura 5. Muestra la evolución de los valores del tiempo de relajación en milisegundos (ms) por mapeo en T2. Los valores se muestran como el promedio ± error estándar. (*) indica p < 0,001 del implante comparado con el valor prequirúrgico (PreQx) y a los 3 meses. (°) indica p < 0,001 del implante comparado con el tejido nativo. ICAME: implante de condrocitos autólogos en matriz encapsulada.
figura7.jpg
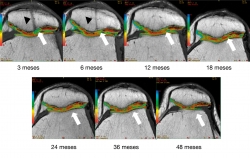
Figura 7. Seguimiento cualitativo subjetivo por mapeo T2. Las flechas blancas indican la zona del implante: obsérvese el cambio progresivo de la ausencia de tejido y la posterior formación de tejido con características morfológicas similares a las del tejido nativo adyacente. Las puntas de flecha negras indican una figura correspondiente a un túnel transpatelar el cual a los 12 meses de postoperado desaparece completamente.
Evaluación de la segunda vista artroscópica
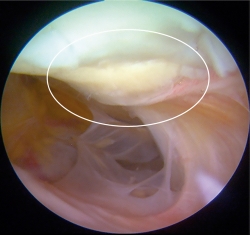
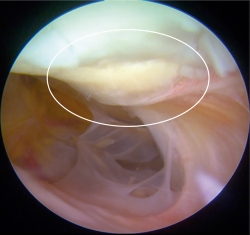
Un total de 9 pacientes accedieron voluntariamente a realizar una segunda vista artroscópica. En todos los casos el implante se observó integrado al tejido adyacente, de aspecto y consistencia similar al cartílago nativo. No observamos ningún caso de hipertrofia del implante. El valor promedio de la evaluación mediante la escala de la ICRS fue de 10,52 ± 0,23, siendo un valor muy cercano al máximo de dicha escala, que es de 12.
Discusión
Presentamos una técnica completamente artroscópica de ICAME en patela. Existe poco escrito en la literatura sobre el acceso a la superficie articular de la patela para el manejo de lesiones condrales y la mayoría de las referencias son cirugías abiertas(6,10,12,13,18,19). Pocas son las técnicas completamente artroscópicas que existen reportadas. Siebold et al.(16) reportan una técnica artroscópica en la cual realizan desbridamiento de la lesión e implante de Chondrospheres®; sin embargo, presenta complejidades técnicas por el posicionamiento del paciente en decúbito prono, ya que además de que la accesibilidad a la articulación en esta posición es difícil, el tratamiento de lesiones condrales en otras zonas (faceta-tróclea o cóndilos) o el manejo de lesiones concomitantes (menisco, ligamentos cruzados, osteotomías) se vuelve imposible en esta posición. Cuéllar et al.(20) describen una técnica artroscópica en decúbito supino que puede usarse para implante autólogo de condrocitos y/o microfracturas aumentadas; sin embargo, esta técnica requiere de la liberación del retináculo lateral o medial para la colocación de fórceps externo y la eversión de la patela. La técnica que presentamos se realiza también en decúbito supino, con la ventaja de no necesitar forzosamente como parte de la técnica la liberación del retináculo lateral o medial, pues mediante el acceso artroscópico se puede visualizar adecuadamente la zona de la lesión. El implante con la rodilla en extensión permite un buen acceso a toda la superficie articular de la patela, permitiendo no solo delimitar la lesión y la colocación del implante, sino también el tratamiento de las lesiones concomitantes y la realización subsecuente de técnicas de descompresión y/o realineación de la patela. En cuanto a la factibilidad de la manipulación del constructo, pese a que este contiene a los condrocitos encapsulados en matriz para protegerlos del efecto de arrastre por el flujo de agua, durante el procedimiento de fijación es posible suspender la presión de la bomba de agua e introducir el implante dejando el flujo de agua solo a gravedad y así garantizar la integridad del implante. Una de las ventajas de técnicas artroscópicas como la aquí descrita es que durante la cirugía podemos valorar en forma dinámica el “encarrilamiento” patelofemoral y determinar, preferentemente en el primer tiempo quirúrgico, si es necesario realizar una técnica adicional de descompresión o centralización de la patela en casos de mala alineación o hiperpresión patelar ya que, como se ha reportado en la literatura, los resultados más satisfactorios en el tratamiento de las lesiones condrales en patela son aquellos en los que además de la reparación de la lesión del cartílago se realiza una corrección de los factores asociados para asegurar un mejor desenlace clínico(14,21).
En esta serie de casos no observamos complicaciones posquirúrgicas severas ni pérdidas del constructo en las evaluaciones subsecuentes. Observamos 1 paciente que desarrolló tendinitis patelar crónica, la cual se manejó de manera conservadora con fisioterapia, presentando mejoría. En cuanto a la calidad del tejido de reparación, observamos que los tiempos de relajación del agua tendieron a alcanzar valores del cartílago nativo después de los 18 meses de seguimiento, no mostrando diferencia significativa y manteniéndose estables hasta los 48 meses. Asimismo, la evaluación clínica mostró mejoría significativa después del procedimiento quirúrgico manteniéndose con adecuada evolución hasta los 48 meses. No observamos ningún caso de hipertrofia del implante en comparación con las técnicas abiertas basadas en parche de periostio(15).
Un estudio multicéntrico reportado por Gomoll et al.(6) refiere una mejoría del IKDC de 40,2 a 69,4 a un seguimiento promedio de 90 meses; de igual forma, en nuestro estudio observamos mejoría significativa muy similar de 43,37 vs. 71,95 a los 48 meses de postoperados, resultando también equiparables a los observados por Filardo et al.(12), quienes reportan una mejoría clínica evaluada con la escala IKDC de 38,1 vs. 69,7 a los 5 años de seguimiento en pacientes con lesión aislada en patela; aunque discretamente mejores a los nuestros, el número de pacientes fue menor en este estudio.
En cuanto a la calidad del tejido reparado, observamos una mejoría del tiempo de relajación del agua en el mapeo T2 del promedio del valor prequirúrgico de 54,99 a un valor de 38,16 a los 48 meses de seguimiento, correspondiendo a los niveles de cartílago sin lesión o de grado I según la clasificación propuesta por Hannila et al.(22) correspondiente al cartílago sin lesión y dentro de los parámetros de normalidad observados por Ruíz Santiago et al.(23) que van de 37,4 a 44,1 según la zona medida. En este estudio reportamos el comportamiento por mapeo T2 del implante de condrocitos autólogos, el cual no se había descrito en los diferentes reportes(5,6,15,16,19,23,24). Pocas son las técnicas completamente artroscópicas que existen reportadas. Siebold et al.(16) y reportamos la mejoría de los valores del tiempo de relajación del agua del implante a través del tiempo hasta llegar a valores similares al tejido nativo, los cuales persisten hasta los 48 meses.
Es importante mencionar que esta técnica es idónea para lesiones condrales focalizadas en patela, especialmente en pacientes jóvenes (edad menor de 40 años), sin obesidad y sin factores agregados que conlleven un mal pronóstico, como son la displasia troclear, la hiperpresión patelofemoral, la hiperelasticidad ligamentaria, defectos angulares de rodilla o la luxación de patela, entre otros. La presencia de factores agregados como los antes mencionados no contraindica necesariamente la realización del implante; sin embargo, se deben tomar en cuenta en el momento de decidir realizar un implante, ya que el éxito de este dependerá directamente del éxito de la previa corrección de dichos factores e inversamente a la cantidad de cirugías que se requieran para corregirlo. La mayor ventaja de la técnica artroscópica en comparación con las técnicas abiertas es en las lesiones principalmente traumáticas que no se acompañan de hiperpresión patelofemoral o defectos angulares de rodilla, ya que al evitar incidir alguno de los retináculos para acceder a la articulación se evita también el sangrado que produce y el riesgo de hemartrosis, así como el riesgo de fibrosis subsecuente.
A pesar de ser una serie de casos con pocos pacientes, los resultados obtenidos por nuestra técnica son alentadores, ya que todos los pacientes presentaron mejoría clínica, además de poder caracterizar la maduración del implante por resonancia magnética nuclear con mapeo en T2. Un estudio comparativo y un mayor seguimiento serán necesarios para fortalecer nuestros resultados.
Conclusiones
La técnica artroscópica de ICAME en patela es una técnica eficaz, segura y reproducible que proporciona una mejoría clínica y de la calidad del tejido de reparación a los 4 años de seguimiento.
Figuras
Figura 1. Técnica de implante artroscópico en patela. A: en la parte superior se muestra una vista externa de la colocación de la guía del ligamento cruzado anterior (LCA); se aprecia un clavillo de Kirschner 0,062 previamente colocado. En la parte inferior se muestra una vista artroscópica por el portal anterolateral de la lesión condral previamente desbridada y la entrada de los 2 clavillos de Kirschner 0,062 equidistantes al centro de la lesión; B: en la parte superior se observan los alambres pasasuturas colocados a través de los túneles realizados mediante los clavillos de Kisrchner, los cuales previamente se retiraron para introducir los alambres pasasuturas. Abajo se muestra la misma vista artroscópica de la lesión una vez cambiados los clavillos de Kirschner por los alambres pasasuturas; C: en la parte superior se observa la introducción de la cánula de 10 mm, la cual en este caso se realiza a través del portal anteromedial. Abajo se muestra una vista artroscópica de la cánula ya introducida por la cual se ha recuperado el extremo articular de los alambres pasasuturas y se han llevado al exterior a través de la cánula. Las flechas negras señalan los clavillos de Kirschner 0,062, las flechas blancas señalan las agujas pasasuturas y los puntos negros indican el centro geométrico de la lesión condral.
Figura 2. Técnica de implante artroscópico en patela. A: en la parte superior se muestra el implante siendo perforado con aguja hipodérmica para pasar la sutura PDS del lado que contacta con la superficie ósea al lado articular y de nuevo al lado que contacta con la superficie ósea. Abajo se muestra cómo queda el implante una vez pasada la sutura; B: en la parte superior se muestra cómo se introducen los extremos libres de la sutura PDS en el ojal de los alambres pasasuturas, los cuales al traccionar permiten recuperar los extremos de la sutura a través del abordaje anterior. Abajo se muestra una vista artroscópica en la cual la sutura PDS ya se ha recuperado por el abordaje anterior; C: en la parte superior se muestra una vista artroscópica dirigida a través de la cánula de 10 mm en la que se observa cómo el implante desciende al traccionar la sutura PDS. En la parte inferior de muestra el implante situado y cubriendo el sitio de la lesión. La línea blanca delimita el implante.
Figura 3. Muestra la evolución de los valores clínicos de las escalas de Lysholm e IKDC (International Knee Documentation Committee) subjetivo. Los valores se muestran como el promedio ± error estándar. (*) indica p < 0,001 comparado con el valor prequirúrgico (PreQx) de cada escala.
Figura 4. Muestra la evolución de los valores clínicos de las escalas de Tegner y Kujala. Los valores se muestran como el promedio ± error estándar. (*) indica p < 0,001 comparado con el valor prequirúrgico (PreQx) de cada escala.
Figura 5. Muestra la evolución de los valores del tiempo de relajación en milisegundos (ms) por mapeo en T2. Los valores se muestran como el promedio ± error estándar. (*) indica p < 0,001 del implante comparado con el valor prequirúrgico (PreQx) y a los 3 meses. (°) indica p < 0,001 del implante comparado con el tejido nativo. ICAME: implante de condrocitos autólogos en matriz encapsulada.
Figura 6. Muestra la evolución de los valores de la diferencia entre el implante y su control de tejido nativo. Los valores se muestran como el promedio ± error estándar. (*) indica p < 0,001 comparado con el valor a los 3 meses.
Figura 7. Seguimiento cualitativo subjetivo por mapeo T2. Las flechas blancas indican la zona del implante: obsérvese el cambio progresivo de la ausencia de tejido y la posterior formación de tejido con características morfológicas similares a las del tejido nativo adyacente. Las puntas de flecha negras indican una figura correspondiente a un túnel transpatelar el cual a los 12 meses de postoperado desaparece completamente.
Figura 8. Segunda vista artroscópica. Se muestra el mismo constructo de la Figura 2C 1 año posterior a ser implantado. Se observan los bordes de la lesión integrados al tejido adyacente, así como integridad del implante.
Tablas
Información del artículo
Cita bibliográfica
Autores
Reynaldo Horacio Arredondo Valdés
Hospital Universitario San Pedro. Logroño
Instituto Nacional de Rehabilitación Luis Guillermo Ibarra Ibarra. México
Anell Olivos Meza
Instituto Nacional de Rehabilitación Luis Guillermo Ibarra Ibarra. México
Félix Enrique Villalobos Córdoba
Instituto Nacional de Rehabilitación Luis Guillermo Ibarra Ibarra. México
Socorro Cortés González
Instituto Nacional de Rehabilitación Luis Guillermo Ibarra Ibarra. México
Francisco Javier Pérez Jiménez
Instituto Nacional de Rehabilitación Luis Guillermo Ibarra Ibarra. México
Arturo Almazán Díaz
Instituto Nacional de Rehabilitación Luis Guillermo Ibarra Ibarra. México
Francisco Cruz López
Instituto Nacional de Rehabilitación Luis Guillermo Ibarra Ibarra. México
Carmen Parra Cid
Instituto Nacional de Rehabilitación Luis Guillermo Ibarra Ibarra. México
Carmina Ortega Sanchéz
Instituto Nacional de Rehabilitación Luis Guillermo Ibarra Ibarra. México
Valentín Martínez López
Instituto Nacional de Rehabilitación Luis Guillermo Ibarra Ibarra. México
María Cristina Velasquillo Martínez
Instituto Nacional de Rehabilitación Luis Guillermo Ibarra Ibarra. México
José Clemente Ibarra Ponce de León
Instituto Nacional de Rehabilitación Luis Guillermo Ibarra Ibarra. México
Premios
Este trabajo fue presentado en el XXII Con greso Internacional AMECRA 2017 el cuál se llevó a cabo del 21 al 24 de junio de 2017 en Veracruz, México, siendo ganador del primer lugar en modalidad de pódium y haciendo acreedor a una beca viajera AMECRA-AEA (Asociación Mexicana de Cirugía Reconstructiva Articular y Artroscopia A.C.-Asociación Española de Artroscopia) llevada a cabo del 18 de febrero al 3 de marzo de 2017.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Financiación. Este trabajo ha sido financiado con la ayuda del Consejo Nacional de Ciencia y Tecnología (CONACYT) con el número de registro de proyecto C01-98 y por la Secretaría de Ciencia, Tecnología e Innovación (SECITI) con número de registro SECITI/INR/SEGOB25/2013.
Conflicto de interés. Los autores declaran no tener ningún conflicto de intereses.
Referencias bibliográficas
-
1Curl WW, Krome J, Gordon ES, Rushing J, Paterson B, Poehling GG. Cartilage Injuries: a Review of 31,516 Knee Arthroscopies. Arthroscopy. 1997;13(4):456-60.
-
2Widuchowski W, Widuchowski J, Trzaska T. Articular cartilage defects: study of 25,124 knee arthroscopies. Knee. 2007;14(3):177-82.
-
3Strauss EJ, Galos DK. The evaluation and management of cartilage lesions affecting the patellofemoral joint. Curr Rev Musculoskelet Med. 2013;6(2):141-9.
-
4Fox AJSA, Wanivenhaus FF, Rodeo SAS. The basic science of the patella: structure, composition, and function. J Knee Surg. 2012;25(2):127-41.
-
5Gillogly SD, Arnold RM. Autologous chondrocyte implantation and anteromedialization for isolated patellar articular cartilage lesions: 5- to 11-year follow-up. Am J Sports Med. 2014;42(4):912-20.
-
6Gomoll AH, Gillogly SD, Cole BJ, Farr J, Arnold R, Hussey K, et al. Autologous Chondrocyte Implantation in the Patella: A Multicenter Experience. Am J Sports Med. 2014;42(5):1074-81.
-
7Steadman JR, Briggs KK, Rodrigo JJ, Kocher MS, Gill TJ, Rodkey WG. Outcomes of Microfracture for Traumatic Chondral Defects of the Knee: Average 11-Year Follow-up. Arthroscopy. 2003;19(5):477-84.
-
8Steadman JR, Rodkey WG, Briggs KK. Microfracture: Its History and Experience of the Developing Surgeon. Cartilage. 2010;1(2):78-86.
-
9Mithoefer K, McAdams T, Williams RJ, Kreuz PC, Mandelbaum BR. Clinical efficacy of the microfracture technique for articular cartilage repair in the knee: an evidence-based systematic analysis. Am J Sports Med. 2009;37(10):2053-63.
-
10Brophy RH, Wojahn RD, Lamplot JD. Cartilage Restoration Techniques for the Patellofemoral Joint. J Am Acad Orthop Surg. 2017;25(5):321-9.
-
11Astur DC, Arliani GG, Binz M, Astur N, Kaleka CC, Amaro JT, et al. Autologous Osteochondral Transplantation for Treating Patellar Chondral Injuries. Evaluation, Treatment, and Outcomes of a Two-Year Follow-up Study. J Bone Joint Surg Am. 2014;96(10):816-23.
-
12Filardo G, Kon E, Andriolo L, Di Martino A, Zaffagnini S, Marcacci M. Treatment of “‘Patellofemoral’” Cartilage Lesions With Matrix-Assisted Autologous Chondrocyte Transplantation A Comparison of Patellar and Trochlear Lesions. Am J Sports Med. 2014;42(3):626-34.
-
13Macmull S, Jaiswal PK, Bentley G, Skinner JA, Carrington RWJ, Briggs TWR. The role of autologous chondrocyte implantation in the treatment of symptomatic chondromalacia patellae. Int Orthop. 2012;36(77):1371-7.
-
14Trinh TQ, Harris JD, Siston RA, Flanigan DC. Improved Outcomes With Combined Autologous Chondrocyte Implantation and Patellofemoral Osteotomy Versus Isolated Autologous Chondrocyte Implantation. Arthroscopy. 2013;29(3):566-74.
-
15Vasiliadis HS, Lindahl A, Georgoulis AD, Peterson L. Malalignment and cartilage lesions in the patellofemoral joint treated with autologous chondrocyte implantation. Knee Surg Sports Traumatol Arthrosc. 2011;19(3):452-7.
-
16Siebold R, Sartory N, Yang Y, Feil Sven, Paessler HH. Prone position for minimal invasive or all-arthroscopic autologous chondrocyte implantation at the patella. Knee Surg Sports Traumatol Arthrosc. 2011;19(12): 2036-9.
-
17Masri M, Lombardero G, Velasquillo C, Martínez V, Neri R, Villegas H, et al. Matrix-Encapsulation Cell-Seeding Technique to Prevent Cell Detachment during Arthroscopic Implantation of Matrix-Induced Autologous Chondrocytes. Arthroscopy. 2007;3(8):877-83.
-
18Niemeyer P, Kreuz PC, Steinswachs M, Köstler W, Mehlhorn A, Kraft N, et al. Technical note: the “‘double eye’” technique as a modification of autologous chondrocyte implantation for the treatment of retropatellar cartilage defects. Knee Surg Sports Traumatol Arthrosc. 2007;15(12):1461-8.
-
19Niemeyer P, Steinwachs M, Erggelet C, Kreuz PC, Kraft N, Wolfgang K, et al. Autologous chondrocyte implantation for the treatment of retropatellar cartilage defects: clinical results referred to defect localisation. Arch Orthop Trauma Surg. 2007;128(11):1223-31.
-
20Cuéllar R, Cuéllar A, Ponte J, Ruíz-Ibán MA. Arthroscopic Technique for the Treatment of Patellar Chondral Lesions With the Patient in the Supine Position. Arthrosc Tech. 2014;3(3):e373-6.
-
21Farr J. Autologous Chondrocyte Implantation and Anteromedialization in the Treatment of Patellofemoral Chondrosis. Orthop Clin North Am. 2008;39(3):329-35.
-
22Hannila I, Nieminen MT, Rauvala E, Tervonen O, Ojala R. Patellar cartilage lesions: comparison of magnetic resonance imaging and T2 relaxation-time mapping. Acta Radiol. 2007;48(4):444-8.
-
23Ruiz Santiago F, Pozuelo Calvo R, Almansa López J, Guzmán Álvarez L, Castellano García M del M. T2 mapping in patellar chondromalacia. Eur J Radiol. 2014;83(6):984-8.
-
24Meyerlort D, Ebert JR, Ackland TR, Robertson WB, Fallon M, Zheng MH, et al. Matrix-induced autologous chondrocyte implantation (MACI) for chondral defects in the patellofemoral joint. Knee Surg Sports Traumatol Arthrosc. 2013;22(10):2522-30.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Felicidades, revista de la AEA
- ¿Existe relación entre el ángulo crítico del hombro y los resultados funcionales tras la reparación del manguito rotador? Resultados preliminares
- Retorno al deporte posterior a una reconstrucción simultánea de ligamento cruzado anterior y ligamento colateral medial de grado III en periodo subagudo
- Resultados objetivos de la ligamentoplastia de ligamento cruzado anterior en la edad pediátrica mediante la técnica intraepifisaria (all-epiphyseal)
- Una nueva técnica artroscópica de implante de condrocitos autólogos en matriz encapsulada (ICAME) en patela: evaluación clínica y por mapeo T2 a 4 años de seguimiento
- Incidencia de calcificaciones heterotópicas tras artroscopia de cadera con técnica fuera-dentro
- Sutura artroscópica del tendón del subescapular. Técnica y resultados
- Revisión sistemática: ligamento anterolateral de la rodilla
- El pórtico
- Lesión de Hill Sachs doble en rueda dentada
- Osteoma osteoide articular de rodilla y su exéresis
Más en PUBMED
Más en Google Scholar
Más en ORCID


Revista Española de Artroscopia y Cirugía Articular está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.