Condrogénesis inducida por matrices (AMIC)
Autologous matrix-induced chondrogenesis (AMIC)
Resumen:
Objetivo: examinar la evolución y la situación actual de la técnica AMIC y conocer los principios biológicos sobre los que se sustenta, así como los resultados de su utilización en el tratamiento de las lesiones condrales.
Método: se realiza una revisión de la bibliografía sobre la ciencia básica relativa a las lesiones de cartílago, la técnica quirúrgica y los resultados clínicos respecto a otras técnicas de reparación y regeneración condral.
Resultados: en los estudios publicados, la técnica AMIC consigue mejoría del dolor y de las escalas clínicas y funcionales, obteniendo mejores resultados que las microfracturas y similares a otras técnicas reparativas.
Conclusiones: la condrogénesis inducida por matrices es una técnica segura, técnicamente reproducible y efectiva para el tratamiento de las lesiones de cartílago, con buenos resultados clínicos para los pacientes. No obstante, hacen falta estudios a largo plazo para conocer su evolución con el tiempo.
Nivel de evidencia: 5.
Relevancia clínica: es importante conocer una de las opciones de que disponemos para el tratamiento de las lesiones condrales. Dentro del abanico de tratamientos que existen, la técnica AMIC es relativamente novedosa y con resultados prometedores.
Abstract:
Objective: To analyze the evolution and current status of the autologous matrix-induced chondrogenesis (AMIC) technique and know its underlying biological principles, as well as the results of its use in treating chondral lesions.
Method: A literature review is made of the basic science referred to cartilage injuries, the surgical technique, and clinical outcomes versus other chondral repair and regeneration techniques.
Results: According to the published studies, AMIC improves pain and the clinical and functional scores, affording better outcomes than microfracture surgery and with results similar to those of other repair techniques.
Conclusions: Matrix-induced chondrogenesis is a safe, technically reproducible and effective technique for the treatment of cartilage injuries, with good clinical outcomes for the patients. However, long-term studies are needed to assess the evolution of the results over time.
Level of evidence: 5.
Clinical relevance: It is important to know one of the options available for the treatment of chondral lesions. Within the range of existing treatments, AMIC is a relatively novel technique affording promising results.
Introducción
El tratamiento de los defectos del cartílago articular supone uno de los mayores retos de la cirugía ortopédica actual, observándose una incidencia del 60% de lesiones condrales en todos los pacientes entre 40 y 50 años(1). Estos defectos dan lugar a síntomas que pueden llegar a condicionar un dolor y una limitación funcional considerables, suponiendo además el desarrollo de artrosis a largo plazo(2,3). Además, se ha observado que estos pacientes tienen situaciones clínicas similares a aquellos con artrosis en espera de una prótesis total de rodilla e incluso peores puntuaciones clínicas que aquellos a la espera de reconstrucción del ligamento cruzado anterior(4). Todo ello es debido a la alta especialización del tejido cartilaginoso, que le permite una correcta transmisión de cargas y proveer una superficie de contacto uniforme a las articulaciones y que, sin embargo, le otorga un potencial de reparación muy limitado, debido a la naturaleza avascular y a la baja actividad mitótica de los condrocitos(5).
El objetivo de la mayoría de los tratamientos está enfocado a crear una superficie articular congruente con propiedades biomecánicas competentes, restaurar la funcionalidad de la articulación y prevenir la degeneración a artrosis. Estos métodos de tratamiento quirúrgico incluyen técnicas reparativas, técnicas regenerativas y técnicas paliativas(6). Las técnicas reparativas implican la utilización de tejido histológicamente distinto al cartilaginoso, mientras que las regenerativas suponen el reemplazo completo del tejido lesionado manteniendo la misma arquitectura y propiedades biomecánicas.
Los métodos reparativos incluyen las técnicas de estimulación de médula ósea, que se han estado utilizando desde que Pridie(7) introdujera en 1959 la perforación subcondral, siendo esta perfeccionada por Steadman(8) hacia las microfracturas, al prescindir de la perforación a motor para evitar la necrosis por calor. Mediante esta técnica se exponen las lesiones condrales a las células estromales mesenquimales (mesenchymal stromal cells –MSC–) provenientes de la médula ósea. Este paso de células y factores de crecimiento forma un coágulo que induce la reparación de la lesión(9). Un elemento importante introducido por Steadman es la correcta preparación del área lesionada, mediante el curetaje de la capa de cartílago calcificado y la exéresis de todo el cartílago patológico hasta la transición a cartílago sano para obtener un lecho capaz de acomodar mejor el coágulo.
Actualmente, gracias a la mejoría en el entendimiento de la arquitectura y la función del hueso subcondral, se ha desarrollado la técnica de las nanofracturas. En esta técnica se utiliza una aguja de menor diámetro que permite una mayor penetración en el hueso subcondral sin producir la compactación de los bordes de las perforaciones. Esto favorece una mayor preservación de la estructura trabecular y una remodelación posterior más parecida al hueso subcondral nativo(10,11). Además, se ha observado en estudios in vivo que las cualidades histológicas del cartílago obtenido eran más parecidas al cartílago hialino que con el desarrollado a partir de las microfracturas(12,13).
Introducida por Behrens(14,15), la condrogénesis autóloga inducida por matriz (AMIC) es un procedimiento que combina las microfracturas con la aplicación de una membrana biodegradable de colágeno de tipo I/III que permite estabilizar y proteger el coágulo formado por las microfracturas. La matriz es fijada al defecto cartilaginoso mediante suturas o pegamento de fibrina. Este procedimiento se puede realizar mediante una miniartrotomía o completamente artroscópico; además, tiene la ventaja de requerir únicamente una cirugía.
En los últimos años se han ido incrementando el número de técnicas AMIC-like, con variaciones en la técnica quirúrgica y el tipo de matriz utilizada. Existen líneas de investigación prometedoras sobre la adición de factores de crecimiento a las matrices que selectivamente reclutarían y estimularían a las células mesenquimales(16,17,18). Estos factores, además, podrían activar a los condrocitos circundantes del cartílago sano para rellenar el defecto osteocondral. El objetivo del siguiente trabajo es revisar los conceptos biológicos subyacentes, la técnica quirúrgica y la situación clínica actual de la condrogénesis inducida por matrices.
Ciencia básica
Las MSC son células progenitoras que se encuentran en una gran variedad de tejidos adultos, entre ellos la médula ósea(19). Estas tienen la capacidad de desarrollarse hacia la formación de tejidos mesodérmicos, entre ellos el cartilaginoso, el óseo y el adiposo(20); para ello, es fundamental la correcta interacción entre las MSC, las proteínas de la matriz extracelular (MEC) y los factores de crecimiento (FC)(21). Tallheden(22) observó que las MSC provenientes de las microfracturas tenían la misma plasticidad fenotípica que las células condrogénicas del sustrato basal. Kramer demostró en su estudio que las matrices de colágeno contenían satisfactoriamente las células provenientes de la médula ósea, ya que pudo aislar MSC en las matrices(23).
La matriz ideal es aquella capaz de imitar la biología, la arquitectura y las propiedades mecánicas del cartílago nativo, con la suficiente fuerza estructural como para soportar los requerimientos mecánicos de la articulación. Debe ser estable en el entorno tisular y permitir la migración y la adhesión celular, así como la proliferación y la diferenciación. Además, el material debe ser biodegradable e ir remodelándose mientras se forma el nuevo cartílago y reemplaza la estructura original, sin la liberación de productos de degradación nocivos y sin estimular una respuesta inflamatoria que podría ser perjudicial para la regeneración tisular(24,25).
Aunque originariamente la técnica AMIC fue descrita con la utilización de una membrana de colágeno I/III(15) (Chondro-Gide®, Geistlich Biomaterials, Wolhausen, Switzerland), se han estado utilizando diferentes matrices de distintos materiales para este procedimiento. Dichos implantes pueden estar formados por polímeros naturales o sintéticos, así como por compuestos mixtos (Tabla 1). Los polímeros naturales más utilizados incluyen el colágeno, el ácido hialurónico, el chitosán (Figura 1), la agarosa y el alginato, y se caracterizan por su alta biocompatibilidad y biodegradabilidad; asimismo, sus superficies contienen ligandos que son reconocidos por receptores celulares, facilitando su adaptación(26). Por otro lado, los polímeros sintéticos como el ácido poliláctico o el poliglicólico se caracterizan por su resistencia mecánica, su ausencia de inmunogenicidad y el nulo riesgo de transmisión de patógenos(25,26).
reaca.28171.fs1907031-figura1.png
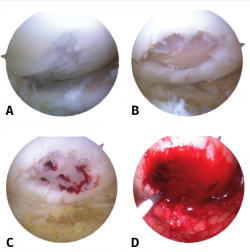
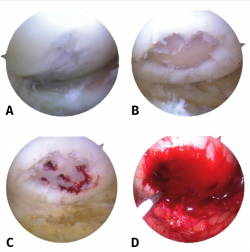
Figura 1. Visión de una rodilla derecha desde el portal anteromedial. Lesión condral de 10 × 10 mm en el cóndilo femoral externo. A: lesión condral de grado II/III de Outerbridge; B: curetaje de la lesión de obtención de hueso subcondral; C: realización de microfracturas; D: colocación de andamiaje de chitosán.
Las matrices compuestas de colágeno I/III son las más utilizadas y están presentes en un mayor número de publicaciones(27,28,29,30). Se estructuran en forma de bicapa, con una superficie porosa que permite la fijación de las MSC a las fibras de colágeno para la proliferación y diferenciación celular, y una superficie lisa no porosa que mantiene el coágulo en el defecto. Esta matriz se reabsorbe entre 6 y 24 semanas postimplantación. Gille(31) demostró en su estudio que las células que se desarrollaban en la membrana formaban una estructura multicapa con células similares a los condrocitos. Gigante(32) realizó biopsias de 5 pacientes a los que había tratado previamente de lesiones condrales y observó una puntuación histológica media de 60 (International Cartilage Repair Society –ICRS–), siendo 100 la máxima similitud con el cartílago articular, así como también reportaba una apariencia a la visión artroscópica similar al cartílago sano.
Existen matrices de ácido poliglicólico absorbible (PGA) tratadas con ácido hialurónico, que actúan como una esponja reteniendo el coágulo y las MSC en el defecto condral(33). En modelos animales se ha observado la formación de cartílago hialino de mayor calidad con el uso de este implante que con la utilización única de microfracturas(34,35); asimismo, el ácido hialurónico ha demostrado ser un inductor de diferenciación condrogénica de las MSC(36,37). La estabilidad mecánica de esta matriz permite un fácil manejo durante la cirugía y una fijación segura tanto con adhesivo de fibrina y suturas, como pines reabsorbibles. Hasta la fecha, su presencia en la literatura se limita a reportes de casos(33,38) y series de casos de bajo número de pacientes(39,40).
También podemos encontrar implantes compuestos de derivados semisintéticos del ácido hialurónico estructurados en fibras dispuestas de manera aleatoria, sin predominar ninguna dirección. Esto facilita el contacto celular y la formación de la matriz extracelular, así como mantener las MSC. Buda(41) describió su uso en 2010, en el que combina la técnica AMIC con el uso de MSC derivadas de médula ósea tras su obtención mediante centrifugado del aspirado de médula de cresta iliaca y de plasma rico en plaquetas (PRP). Estas membranas se impregnan con el concentrado de MSC y se depositan en el defecto para, posteriormente, aplicar la solución de PRP aportando los factores de crecimiento. Vannini(42) reprodujo la técnica en 6 pacientes con osteocondritis disecante con buenos resultados.
Técnica quirúrgica
La técnica quirúrgica original fue descrita por Benthiem y Behrens(14,15) para defectos condrales en la rodilla. Sus indicaciones para la técnica son lesiones condrales u osteocondrales menores de 1,5 cm2. En el caso de lesiones osteocondrales, los autores rellenan el defecto óseo con hueso esponjoso de tibia proximal, lo impactan y colocan sobre él la membrana. Las contraindicaciones para esta técnica consisten en: lesiones en espejo o de etiología inflamatoria, lesiones de los ligamentos colaterales o de los cruzados, déficit de extensión mayor de 10° o de flexión mayor de 100°, mala alineación del miembro inferior y fracturas asociadas.
El procedimiento se puede realizar bajo anestesia espinal o general. El paciente se coloca en decúbito supino y se aconseja la utilización de un torniquete de isquemia. Inicialmente, se realiza una artroscopia de la articulación afectada para comprobar el tamaño y la localización del defecto, así como diagnosticar posibles lesiones asociadas. Si se cumplen las indicaciones para llevar a cabo el procedimiento AMIC, los autores indican realizar una artrotomía mínimamente invasiva. Mediante la visión directa de la lesión se procede al curetaje del tejido cartilaginoso defectuoso hasta la presencia de cartílago sano, así como la retirada de la capa de cartílago calcificada hasta la aparición del tejido subcondral. A continuación, se procede a la realización de microfracturas, de acuerdo con la técnica descrita por Steadman(8).
Una vez hecho este proceso, se determina el tamaño final del defecto condral, para calcular las dimensiones de la membrana a colocar. Se recomienda utilizar alguna plantilla para trasladar el tamaño correcto a la matriz; algunos cirujanos se sirven de láminas de aluminio o de plástico para este propósito. Los autores sugieren elegir un tamaño ligeramente inferior al del defecto para evitar su desplazamiento con el movimiento de la articulación.
El siguiente paso corresponde a la fijación de la membrana. El método de fijación preferido por Behrens es mediante el adhesivo de fibrina parcialmente autóloga, obtenido por la centrifugación de sangre periférica del paciente y su mezcla con fibrinógeno exógeno. También existe la posibilidad de utilizar preparados comerciales de fibrina. Es aconsejable la colocación de la membrana ligeramente por debajo del nivel del cartílago para evitar el desplazamiento posterior (Figura 2).
reaca.28171.fs1907031-figura2.png
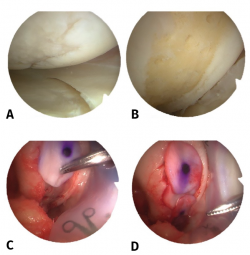
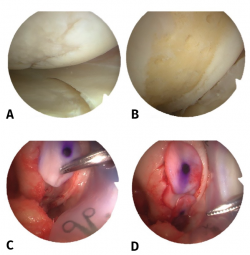
Figura 2. Visión de una rodilla derecha desde el portal anteroexterno. Lesión condral en cóndilo femoral interno de 10 × 20 mm. A: lesión condral de grado III de Outerbridge; B: lesión saneada hasta el hueso subcondral y realización de microfracturas; C: colocación de matriz de colágeno I/III; D: visión final con cobertura completa del defecto condral.
Para el manejo postoperatorio, algunos autores recomiendan inmovilizar la rodilla durante 7 días en extensión(43). Otros mantienen la extremidad intervenida en descarga por un periodo de entre 2 y 6 semanas(41,42,43,44). La mayoría de los cirujanos permiten las actividades de impacto tras los 6 meses y las actividades deportivas a partir del año de la intervención. Los autores descriptores de la técnica original permiten carga parcial máxima de 15 a 20 kg durante 6 semanas. Además, se limita la flexión máxima de rodilla a 30° durante 2 semanas y aumento progresivo a 60 y 90° a partir de las 4 y 6 semanas, respectivamente, con incorporación de ejercicios de fortalecimiento muscular y rango articular.
En los últimos años, se han descrito técnicas puramente artroscópicas. Piontek(45) en 2012 describe su variación de la técnica en la que, tras realizar el curetaje, utiliza trefinas para determinar el tamaño de la lesión. Posteriormente, en condiciones de artroscopia seca, realiza perforaciones subcondrales para, a continuación, colocar la membrana de Chondro-Gide® en el defecto. Por último, cubre la membrana con adhesivo de fibrina comercial (Tissucol®, Baxter, Varsovia, Polonia) y comprueba la estabilidad realizando movimientos de flexoextensión; posteriormente, anota el rango articular en el que la lesión permanece en descarga para determinar el rango seguro de movilidad para la rehabilitación. No utiliza drenajes para evitar el desplazamiento de la membrana.
Sadlik(46) en 2015 describe su técnica artroscópica para el tratamiento de lesiones patelares. En esta, utiliza una placa retractora ligada a suturas extraarticulares que coloca bajo el retináculo patelar medial y le permite elevar e inclinar la rótula para observar mejor la lesión y mantener el espacio de trabajo en el tiempo seco de la artroscopia. Además, se sirve de una guía y un introductor para introducir la matriz y posicionarla correctamente sobre el defecto condral.
Schagemann(47), en un estudio de 50 pacientes, realiza la comparación de la técnica artroscópica versus la técnica con miniartrotomía concluyendo que no existen diferencias significativas en los resultados; sin embargo, la decisión de elegir una u otra técnica ha de radicar en las habilidades del cirujano.
Diversas técnicas artroscópicas han sido propuestas para tratar lesiones condrales en otras articulaciones, como en tobillo(48,49), la cadera(50) y el hombro(51).
Evidencia clínica
Buda(41) realizó la técnica AMIC en 20 pacientes con el uso de Hyalofast® junto con MSC y PRP obteniendo una mejoría de la puntuación del International Knee Documentation Committee (IKDC) y del Knee Injury and Osteoarthritis Outcome Score (KOOS) estadísticamente significativa. En los controles de resonancia magnética (RM) realizados a los 12 y 24 meses, observó una mejoría de la puntuación del Magnetic Resonance Observation of Cartilage Repair Tissue (MOCART), así como una relación estadísticamente significativa entre la puntuación KOOS a los 24 meses y la intensidad de señal en la RM. En el análisis histológico apreció una matriz rica en proteoglicanos, una capa superficial casi regular con presencia de células distribuidas homogéneamente por el tejido y la positividad de colágeno de tipo II a lo largo de todo el espesor de la biopsia.
En el estudio realizado por Vannini(42) con la utilización de la misma técnica en 6 pacientes de entre 14 y 18 años con osteocondritis disecante y con un defecto medio de 4,6 ± 1,5 cm2 se reprodujeron los mismos resultados clínicos satisfactorios, con un incremento de la puntuación IKDC, pero sin una correlación significativa entre los parámetros MOCART y las escalas clínicas.
Kusano(27) en 2012 publicó los resultados de 38 pacientes tratados de lesiones únicas, mayores de 2 cm2 y de menos de 50 años de edad con la utilización de Chondro-Gide®. Encontró aumentos significativos en las escalas IKDC y Lysholm, pero la puntuación MOCART no se correlacionaba con los resultados clínicos, ya que la mayoría de las lesiones mostraban una reparación incompleta del defecto, con un tejido de reparación dañado y una estructura heterogénea, así como una lámina subcondral alterada.
Pascarella(52) modificó la técnica para tratar de incrementar la carga de MSC. Para ello, realizó perforaciones en lugar de microfracturas e impregnó la matriz de Chondro-Gide® en concentrado de médula ósea obtenido directamente del aspirado a través de una de las perforaciones. Los resultados clínicos (escalas IKDC y Lysholm) mostraron un incremento similar al obtenido por Kusano(27) y en la RM postoperatoria halló una reducción significativa del área de defecto y del edema subcondral en el 53% de los pacientes.
En 2010, Gille(43) publica los resultados de 32 lesiones condrales tratadas con membranas de colágeno I/III en 27 pacientes de entre 16 y 50 años con un defecto medio de 4,2 cm2 y un seguimiento mínimo de 2 años. En el estudio observa un incremento significativo de las puntuaciones en la escala de Lysholm y en la escala de la ICRS durante los primeros 24 meses de seguimiento, mientras que disminuían a partir de los 2 años. En 2012(28), como parte del Registro AMIC, amplía la muestra a 57 pacientes, hallando un incremento significativo de la puntuación en la escala de Lysholm y en la visual analógica del dolor (VAS).
En un estudió más reciente de 21 pacientes con un seguimiento medio de 7 años se encontró un aumento significativo de las puntuaciones IKDC y Lysholm durante toda la etapa de seguimiento(53). Además, no se halló correlación entre la edad y el índice de masa corporal (IMC) con los índices funcionales. Se observó también una reducción del área del defecto y del edema subcondral en el 66% de los pacientes.
Respecto a las lesiones en la articulación del tobillo, se ha observado una mejoría significativa en la escala VAS, así como de la puntuación de la American Orthopaedic Foot and Ankle Society (AOFAS) de tobillo en los trabajos de D’ambrosi(54,55), Usuelli(1,2) y Valderrábano(56,57). Del mismo modo, la evaluación del cartílago en la RM mostró un aumento de la puntuación MOCART(48,56).
Varios trabajos han obtenido mejoría de la puntuación Harris Hip Score modificada (mHHS) en los defectos condrales en la cadera(58,59,60). Fontana(58) comparó la técnica AMIC frente a las microfracturas para las lesiones acetabulares inducidas por pinzamiento femoroacetabular (PFA) y observó que la mejoría clínica se mantenía estable a lo largo de los 5 años del seguimiento, mientras que en el grupo de las microfracturas se deterioraba gradualmente.
Discusión
La condrogénesis inducida por matrices es una opción terapéutica que permite tratar lesiones de cartílago mediante la colocación de una membrana capaz de contener y estimular a las MSC para generar tejido cartilaginoso. En las revisiones sistemáticas realizadas por Shaikh(61) y Gao(62) informan de la escasez de estudios aleatorizados y de alta calidad que existen, debido concretamente al escaso número de pacientes, la longitud del seguimiento y el diseño del estudio. Esto se observa especialmente en los estudios comparativos con otras técnicas reparadoras. No existen actualmente ensayos clínicos que comparen el AMIC con la implantación autóloga de condrocitos (ACI) en la rodilla o en el tobillo, así como tampoco existen para la comparación con las microfracturas en este último.
Sí existen, por el contrario, estudios aleatorizados que comparan AMIC con el uso único de las microfracturas(63,64). En el estudio de Anders(64), el autor compara 38 pacientes con lesiones de un tamaño medio de 3,4 cm2 y de 37 años de edad media con un seguimiento de 2 años. Observó un incremento significativo en la escala ICRS y en la escala modificada de Cincinnati tanto para las microfracturas como para el grupo AMIC al año de seguimiento, así como un mantenimiento del incremento a los 2 años. Entre los grupos no halló diferencias significativas. Volz(63) encontró hallazgos similares a los 2 años; sin embargo, a los 5 años se observaba una disminución significativa en los resultados clínicos en el grupo de las microfracturas, mientras se mantenían o incluso mejoraban en el grupo AMIC.
En la técnica ACI, se recogen muestras de cartílago de una zona donante no de carga o de la lesión condral para, posteriormente, procesarlas en un laboratorio para liberar los condrocitos y cultivarlos. En una segunda intervención, estos condrocitos son implantados en el defecto. La tercera generación de este proceso, la implantación de condrocitos autólogos inducida por matriz (MACI), incluye la utilización de una membrana para mantener los condrocitos en la lesión. Únicamente hay constancia en la literatura de un trabajo que compare la técnica AMIC con la MACI(60). En este trabajo, Mancini(60) compara, para lesiones de cadera de 2 a 4 cm2, a 2 grupos de pacientes tratados con AMIC o con MACI, concluyendo que ambos grupos muestran mejoría clínica pero sin diferencias significativas en los 5 años de seguimiento. No obstante, el estudio no estaba aleatorizado ni añadía información de RM mediante MOCART.
Sí existen estudios de alta calidad que la confrontan a otras técnicas como las microfracturas(65,66) y la mosaicoplastia(67), de los cuales podemos sugerir que con la técnica AMIC se obtienen resultados similares a los obtenidos con la técnica ACI, con la ventaja de que solo se requiere una intervención para realizar el AMIC y no es necesaria la estructura y la logística del laboratorio.
Debido a la relativa novedad de este tratamiento, existe una escasez de estudios que muestren los resultados a largo plazo. Los trabajos encontrados con mayor seguimiento suponen un periodo de 5 años(43,56,58,60). Gille(43) observa que existe una disminución de los resultados clínicos a partir de los 18 a 24 meses en las escalas ICRS, Lysholm y Tegner. Anders muestra también una tendencia a la estabilidad de los resultados clínicos a partir de los 12 con incluso con un 11% de pacientes con descenso en los valores clínicos. Sin embargo, Fontana(58) y Mancini(60) mostraban unos buenos resultados mantenidos a lo largo de los 5 años de los estudios, aunque todos los pacientes habían sufrido intervenciones adicionales para el tratamiento del PFA.
En varios estudios se incluyen intervenciones adicionales asociadas al tratamiento de las lesiones condrales, como las osteotomías de realineación(27,41,43,56,68) o el tratamiento del PFA(58,60), lo que dificulta determinar si el efecto clínico es resultado de la reparación del defecto cartilaginoso, de las cirugías asociadas o de ambas. Únicamente Kusano(27) compara a los pacientes tratados exclusivamente mediante la técnica AMIC con aquellos a los que se les asociaba una osteotomía realineadora, sin hallar diferencias significativas en los resultados. Debido a esta variabilidad en los tratamientos asociados, es complejo comparar los protocolos de rehabilitación y determinar el más adecuado.
Hasta la fecha, ningún estudio ha informado de efectos adversos graves relacionados con esta técnica. En cuanto a las reintervenciones, estas se limitan a la eliminación de osteofitos intralesionales(29,68), a menudo en relación con el procedimiento de las microfracturas.
Desde el punto de vista del procedimiento, varias técnicas de microfracturas se han utilizado como primer paso para la realización del AMIC. Desde la utilización de punzones(27,43,58,60,64) hasta de motores(56,58), pero no existen estudios comparativos que se decanten por la mejor manera de realizar las microfracturas dentro de la técnica AMIC. No obstante, sí se ha observado una mayor calidad del cartílago obtenido a partir de las nanofracturas comparado con el obtenido tras microfracturas en estudios in vivo(12,13).
Otro aspecto técnico clave es la fijación de la matriz. Esta se puede realizar mediante suturas, adhesivos de fibrina o anclajes subcondrales. Las suturas y la fibrina otorgan suficiente estabilidad a la membrana(69), aunque se ha observado que estas primeras, además de ser técnicamente más demandantes, inducen daño local al cartílago sano similar a estadios incipientes de artrosis(70). Estudios más recientes otorgan la mayor resistencia mecánica a la fijación con anclajes subcondrales(71). En los estudios de Volz(63) y Anders(64) se comparan 2 grupos de pacientes con fijación por suturas y otro con fijación con adhesivo de fibrina, sin encontrar diferencias clínicas ni radiológicas significativas entre ambos.
Por lo que respecta a la constitución de las matrices, Welsch(72) observó que el tejido de reparación era mejor en las matrices de colágeno que en las basadas en ácido hialurónico, según criterios radiológicos, lo que contrasta con estudios que sugieren que el hialurónico es capaz de inducir la condrogénesis(73,74). Wu(74) demostró que añadir ácido hialurónico a matrices de ácido poliláctico-co-glicólico (PLGA) producía mayores niveles de colágeno de tipo II y de glicosaminoglicanos. Mecánicamente, se ha encontrado que las matrices de PGA son capaces de soportar las mayores cargas, independientemente de la fijación utilizada, en comparación con las membranas de colágeno y las de PLGA(31).
Por otra parte, en una reciente revisión sistemática, Gao(75) concluye que no existe suficiente evidencia de que los biomateriales compuestos de colágeno I/III puedan inducir por ellos mismos la condrogénesis; es más, observa en función de estudios in vitro que las matrices de colágeno II inducen mayor proliferación celular y mayor acumulación de colágenos y glicosaminoglicanos que las matrices de colágeno (76).
Conclusión
La condrogénesis inducida por matrices es una técnica segura, técnicamente reproducible y efectiva para el tratamiento de las lesiones de cartílago, con buenos resultados clínicos para los pacientes. Además, presenta la ventaja de poder realizarse en una única intervención y sin la morbilidad asociada a la creación de una zona donante, a diferencia de la técnica ACI o la mosaicoplastia. No obstante, se requieren estudios aleatorizados, con mayor número de pacientes y con una mejor metodología para compararla con las demás opciones terapéuticas existentes. Del mismo modo, hacen falta trabajos a largo plazo para conocer si es capaz de evitar o retrasar la degeneración articular.
Tablas
Figuras
Figura 1. Visión de una rodilla derecha desde el portal anteromedial. Lesión condral de 10 × 10 mm en el cóndilo femoral externo. A: lesión condral de grado II/III de Outerbridge; B: curetaje de la lesión de obtención de hueso subcondral; C: realización de microfracturas; D: colocación de andamiaje de chitosán.
Figura 2. Visión de una rodilla derecha desde el portal anteroexterno. Lesión condral en cóndilo femoral interno de 10 × 20 mm. A: lesión condral de grado III de Outerbridge; B: lesión saneada hasta el hueso subcondral y realización de microfracturas; C: colocación de matriz de colágeno I/III; D: visión final con cobertura completa del defecto condral.
Información del artículo
Cita bibliográfica
Autores
Eduardo Sánchez Alepuz
Servicio de Ortopedia y Traumatología. Hospital IMED. Valencia
Joan Part Soriano
Servicio de Cirugía Ortopédica y Traumatología. Unión de Mutuas. Valencia
Grupo de Estudio e Investigación del Cartílago Articular de Valencia (GEICAV)
Ignacio Peregrín Nevado
Servicio de Cirugía Ortopédica y Traumatología. Hospital IMED Valencia. Burjassot, Valencia
Grupo de Estudio e Investigación del Cartílago Articular de Valencia (GEICAV)
Javier Zurriaga Carda
Servicio de Cirugía Ortopédica y Traumatología. Hospital IMED Valencia. Burjassot, Valencia
Grupo de Estudio e Investigación del Cartílago Articular de Valencia (GEICAV)
Jean Maria Gómez Alessandri
Servicio de Cirugía Ortopédica y Traumatología. Unión de Mutuas. Valencia
Grupo de Estudio e Investigación del Cartílago Articular de Valencia (GEICAV)
Jose Vicente Díaz
Servicio de Cirugía Ortopédica y Traumatología. IMED Valencia. Burjassot, Valencia
Grupo de Estudio e Investigación del Cartílago Articular de Valencia (GEICAV)
Rafael Calero Ferrandiz
Servicio de Cirugía Ortopédica y Traumatología. Unión de Mutuas. Valencia
Grupo de Estudio e Investigación del Cartílago Articular de Valencia (GEICAV)
Responsabilidades éticas
Conflicto de interés. Los autores declaran no tener ningún conflicto de intereses.
Financiación. Este trabajo no ha sido financiado.
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Referencias bibliográficas
-
1Widuchowski W, Widuchowski J, Trzaska T. Articular cartilage defects: Study of 25,124 knee arthroscopies. Knee. 2007;14(3):177-82.
-
2Alford JW, Cole BJ. Cartilage Restoration, Part 1: Basic Science, Historical Perspective, Patient Evaluation, and Treatment Options. Am J Sports Med. 2005;33(2):295-306.
-
3Mankin HJ. The response of articular cartilage to mechanical injury. J Bone Joint Surg Am. 1982;64(3):460-6.
-
4Heir S, Nerhus TK, Røtterud JH, Løken S, Ekeland A, Engebretsen L, Arøen A. Focal Cartilage Defects in the Knee Impair Quality of Life as Much as Severe Osteoarthritis: A Comparison of Knee Injury and Osteoarthritis Outcome Score in 4 Patient Categories Scheduled for Knee Surgery. Am J Sports Med. 2009;38(2):231-7.
-
5Gomoll AH, Minas T. The quality of healing: articular cartilage. Wound Repair Regen. 2014;22:30-8.
-
6Zylińska B, Silmanowicz P, Sobczyńska-Rak A, Jarosz Ł, Szponder T. Treatment of articular cartilage defects: focus on tissue engineering. In Vivo. 2018;32(6):1289-300.
-
7Pridie KH. A method of resurfacing osteoarthritic knee joints. J Bone Joint Surg. 1959:618-9.
-
8Steadman JR, Rodkey WG, Rodrigo JJ. Microfracture: surgical technique and rehabilitation to treat chondral defects. Clin Orthop Relat Res. 2001;(391 Suppl):S362-9.
-
9Steadman JR, Rodkey WG, Briggs KK. Microfracture to treat full-thickness chondral defects: surgical technique, rehabilitation, and outcomes. J Knee Surg. 2002;15(3):170-6.
-
10Zedde P, Cudoni S, Manunta L, Passino ES, Masala G, Brunetti A, et al. Second generation needling techniques for the treatment of chondral defects in animal model. Joints. 2017;5(1):27-33.
-
11Zedde P, Cudoni S, Giachetti G, Manunta ML, Masala G, Brunetti A, Manunta AF. Subchondral bone remodeling: Comparing nanofracture with microfracture. An ovine in vivo study. Joints. 2016;4(2):87-93.
-
12Chen H, Hoemann CD, Sun J, Chevrier A, McKee MD, Shive MS, et al. Depth of subchondral perforation influences the outcome of bone marrow stimulation cartilage repair. J Orthop Res. 2011;29(8):1178-4.
-
13Orth P, Duffner J, Zurakowski D, Cucchiarini M, Madry H. Small-Diameter Awls Improve Articular Cartilage Repair After Microfracture Treatment in a Translational Animal Model. Am J Sports Med. 2016;44(1):209-19.
-
14Benthien JP, Behrens P. The treatment of chondral and osteochondral defects of the knee with autologous matrix-induced chondrogenesis (AMIC): method description and recent developments. Knee Surg Sport Traumatol Arthrosc. 2011;19(8):1316-9.
-
15Benthien JP, Behrens P. Autologous matrix-induced chondrogenesis (AMIC): combining microfracturing and a collagen I/III matrix for articular cartilage resurfacing. Cartilage. 2010;1(1):65-8.
-
16Ge Z, Li C, Heng BC, Cao G, Yang Z. Functional biomaterials for cartilage regeneration. J Biomed Mater Res A. 2012 Sep;100(9):2526-36.
-
17Hsieh YH, Hsieh MF, Fang CH, Jiang CP, Lin B, Lee HM. Osteochondral Regeneration Induced by TGF-β Loaded Photo Cross-Linked Hyaluronic Acid Hydrogel Infiltrated in Fused Deposition-Manufactured Composite Scaffold of Hydroxyapatite and Poly (Ethylene Glycol)-Block-Poly(ε-Caprolactone). Polymers (Basel). 2017;9(12):182.
-
18Bian L, Zhai DY, Tous E, Rai R, Mauck RL, Burdick JA. Enhanced MSC chondrogenesis following delivery of TGF-beta3 from alginate microspheres within hyaluronic acid hydrogels in vitro and in vivo. Biomaterials. 2011;32(27):6425-34.
-
19Yoo JU, Barthel TS, Nishimura K, Solchaga L, Caplan AI, Goldberg VM, Johnstone B. The chondrogenic potential of human bone-marrow-derived mesenchymal progenitor cells. J Bone Joint Surg Am. 1998 Dec;80(12):1745-57.
-
20Mackay AM, Beck SC, Murphy JM, Barry FP, Chichester CO, Pittenger MF. Chondrogenic differentiation of cultured human mesenchymal stem cells from marrow. Tissue Eng. 1998;4(4):415-28.
-
21Van der Kraan PM, Buma P, van Kuppevelt T, van den Berg WB. Interaction of chondrocytes, extracellular matrix and growth factors: relevance for articular cartilage tissue engineering. Osteoarthr Cartil. 2002;10(8):631-7.
-
22Tallheden T, Dennis JE, Lennon DP, Sjogren-Jansson E, Caplan AI, Lindahl A. Phenotypic plasticity of human articular chondrocytes. J Bone Joint Surg Am. 2003;85-A Suppl:93-100.
-
23Kramer J, Bohrnsen F, Lindner U, Behrens P, Schlenke P, Rohwedel J. In vivo matrix-guided human mesenchymal stem cells. Cell Mol Life Sci. 2006;63(5):616-26.
-
24Żylińska B, Silmanowicz P, Sobczyńska-Rak A, Jarosz Ł, Szponder T. Treatment of Articular Cartilage Defects: focus on Tissue Engineering. In Vivo. 2018 Nov-Dec;32(6):1289-300.
-
25Fahmy MD, Shah B, Razavi M, et al. Smart Biomaterials for Tissue Engineering of Cartilage. RSC Smart Mater. 2017;2017(25):194-229.
-
26Chiang H, Jiang CC. Repair of articular cartilage defects: review and perspectives. J Formos Med Assoc. 2009;108(2):87-101.
-
27Kusano T, Jakob RP, Gautier E, Magnussen RA, Hoogewoud H, Jacobi M. Treatment of isolated chondral and osteochondral defects in the knee by autologous matrix-induced chondrogenesis (AMIC). Knee Surg Sport Traumatol Arthrosc. 2012;20(10):2109-15.
-
28Gille J, Behrens P, Volpi P, de Girolamo L, Reiss E, Zoch W, Anders S. Outcome of Autologous Matrix Induced Chondrogenesis (AMIC) in cartilage knee surgery: data of the AMIC Registry. Arch Orthop Trauma Surg. 2013 Jan;133(1):87-93.
-
29Dhollander A, Moens K, Van der Maas J, Verdonk P, Almqvist KF, Victor J. Treatment of patellofemoral cartilage defects in the knee by autologous matrix-induced chondrogenesis (AMIC). Acta Orthop Belg. 2014;80(2):251-9.
-
30Sadlik B, Puszkarz M, Kosmalska L, Wiewiorski M. All-Arthroscopic Autologous Matrix-Induced Chondrogenesis-Aided Repair of a Patellar Cartilage Defect Using Dry Arthroscopy and a Retraction System. J Knee Surg. 2017;30(9):925-9.
-
31Gille J, Meisner U, Ehlers EM, Muller A, Russlies M, Behrens P. Migration pattern, morphology and viability of cells suspended in or sealed with fibrin glue: a histomorphologic study. Tissue Cell. 2005;37(5):339-48.
-
32Gigante A, Calcagno S, Cecconi S, Ramazzotti D, Manzotti S, Enea D. Use of collagen scaffold and autologous bone marrow concentrate as a one-step cartilage repair in the knee: histological results of second-look biopsies at 1 year follow-up. Int J Immunopathol Pharmacol. 2011;24(1 Suppl 2):69-72.
-
33Patrascu JM, Freymann U, Kaps C, Poenaru DV. Repair of a post-traumatic cartilage defect with a cell-free polymer-based cartilage implant. J Bone Joint Surg Br. 2010;92-B(8):1160-3.
-
34Erggelet C, Endres M, Neumann K, Morawietz L, Ringe J, Haberstroh K, et al. Formation of cartilage repair tissue in articular cartilage defects pretreated with microfracture and covered with cell-free polymer-based implants. J Orthop Res. 2009;27(10):1353-60.
-
35Erggelet C, Neumann K, Endres M, Haberstroh K, Sittinger M, Kaps C. Regeneration of ovine articular cartilage defects by cell-free polymer-based implants. Biomaterials. 2007;28(36):5570-80.
-
36Hegewald AA, Ringe J, Bartel J, Krüger I, Notter M, Barnewitz D, et al. Hyaluronic acid and autologous synovial fluid induce chondrogenic differentiation of equine mesenchymal stem cells: a preliminary study. Tissue Cell. 2004;36(6):431-8.
-
37Saw KY, Anz A, Merican S, Tay YG, Ragavanaidu K, Jee CS, McGuire DA. Articular cartilage regeneration with autologous peripheral blood progenitor cells and hyaluronic acid after arthroscopic subchondral drilling: a report of 5 cases with histology. Arthroscopy. 2011 Apr;27(4):493-506.
-
38Zantop T, Petersen W. Arthroscopic implantation of a matrix to cover large chondral defect during microfracture. Arthroscopy. 2009 Nov;25(11):1354-60.
-
39Becher C, Ettinger M, Ezechieli M, Kaps C, Ewig M, Smith T. Repair of retropatellar cartilage defects in the knee with microfracture and a cell-free polymer-based implant. Arch Orthop Trauma Surg. 2015;135(7):1003-10.
-
40Dhollander AAM, Verdonk PCM, Lambrecht S, Almqvist KF, Elewaut D, Verbruggen G, Verdonk R. The combination of microfracture and a cell-free polymer-based implant immersed with autologous serum for cartilage defect coverage. Knee Surg Sport Traumatol Arthrosc. 2012;20(9):1773-80.
-
41Buda R, Vannini F, Cavallo M, Grigolo B, Cenacchi A, Giannini S. Osteochondral lesions of the knee: a new one-step repair technique with bone-marrow-derived cells. J Bone Joint Surg Am. 2010 Dec;92 Suppl 2:2-11.
-
42Vannini F, Battaglia M, Buda R, Cavallo M, Giannini S. “One Step” Treatment of Juvenile Osteochondritis Dissecans in the Knee: Clinical Results and T2 Mapping Characterization. Orthop Clin North Am. 2012;43(2):237-44.
-
43Gille J, Schuseil E, Wimmer J, Gellissen J, Schulz AP, Behrens P. Mid-term results of Autologous Matrix-Induced Chondrogenesis for treatment of focal cartilage defects in the knee. Knee Surg Sport Traumatol Arthrosc. 2010;18(11):1456-64.
-
44Dhollander AA, Verdonk PC, Lambrecht S, Verdonk R, Elewaut D, Verbruggen G, Almqvist KF. Midterm results of the treatment of cartilage defects in the knee using alginate beads containing human mature allogenic chondrocytes. Am J Sports Med. 2012 Jan;40(1):75-82.
-
45Piontek T, Ciemniewska-Gorzela K, Szulc A, Naczk J, Słomczykowski M. All-arthroscopic AMIC procedure for repair of cartilage defects of the knee. Knee Surg Sport Traumatol Arthrosc. 2012;20(5):922-5.
-
46Sadlik B, Wiewiorski M. Implantation of a collagen matrix for an AMIC repair during dry arthroscopy. Knee Surg Sport Traumatol Arthrosc. 2015;23(8):2349-52.
-
47Schagemann J, Behrens P, Paech A, Riepenhof H, Kienast B, Mittelstädt H, Gille J. Mid-term outcome of arthroscopic AMIC for the treatment of articular cartilage defects in the knee joint is equivalent to mini-open procedures. Arch Orthop Trauma Surg. 2018;138(6):819-25.
-
48Usuelli FG, D’Ambrosi R, Maccario C, Boga M, de Girolamo L. All-arthroscopic AMIC® (AT-AMIC®) technique with autologous bone graft for talar osteochondral defects: clinical and radiological results. Knee Surg Sport Traumatol Arthrosc. 2018;26(3):875-81.
-
49Baumfeld T, Baumfeld D, Prado M, Nery C. All-arthroscopic AMIC® (AT-AMIC) for the treatment of talar osteochondral defects: A short follow-up case series. Foot. 2018;37(February):23-7.
-
50Fontana A. A novel technique for treating cartilage defects in the hip: a fully arthroscopic approach to using autologous matrix-induced chondrogenesis. Arthrosc Tech. 2012;1(1):e63-8.
-
51Cuéllar A, Ruiz-Ibán MA, Cuéllar R. The Use of All-Arthroscopic Autologous Matrix-Induced Chondrogenesis for the Management of Humeral and Glenoid Chondral Defects in the Shoulder. Arthrosc Tech. 2016;5(2):e223-e227.
-
52Pascarella A, Ciatti R, Pascarella F, Latte C, Di Salvatore MG, Liguori L, Iannella G. et al. Treatment of articular cartilage lesions of the knee joint using a modified AMIC technique. Knee Surg Sport Traumatol Arthrosc. 2010;18(4):509-13.
-
53Schiavone Panni A, Del Regno C, Mazzitelli G, D’Apolito R, Corona K, Vasso M. Good clinical results with autologous matrix-induced chondrogenesis (Amic) technique in large knee chondral defects. Knee Surg Sport Traumatol Arthrosc. 2018;26(4):1130-6.
-
54D’Ambrosi R, Maccario C, Ursino C, Serra N, Usuelli FG. Combining Microfractures, Autologous Bone Graft, and Autologous Matrix-Induced Chondrogenesis for the Treatment of Juvenile Osteochondral Talar Lesions. Foot Ankle Int. 2017;38(5):485-95.
-
55D’Ambrosi R, Maccario C, Serra N, Liuni F, Usuelli FG. Osteochondral Lesions of the Talus and Autologous Matrix-Induced Chondrogenesis: Is Age a Negative Predictor Outcome? Arthroscopy. 2017;33(2):428-35.
-
56Valderrábano V, Miska M, Leumann A, Wiewiorski M. Reconstruction of osteochondral lesions of the talus with autologous spongiosa grafts and autologous matrix-induced chondrogenesis. Am J Sports Med. 2013;41(3):519-27.
-
57Valderrábano V, Barg A, Alattar A, Wiewiorski M. Osteochondral lesions of the ankle joint in professional soccer players: treatment with autologous matrix-induced chondrogenesis. Foot Ankle Spec. 2014;7(6):522-8.
-
58Fontana A, De Girolamo L. Sustained five-year benefit of autologous matrix-induced chondrogenesis for femoral acetabular impingement-induced chondral lesions compared with microfracture treatment. Bone Joint J. 2015;97-B(5):628-35.
-
59Fontana A. Autologous Membrane Induced Chondrogenesis (AMIC) for the treatment of acetabular chondral defect. Muscles Ligaments Tendons J. 2016;6(3):367-71.
-
60Mancini D, Fontana A. Five-year results of arthroscopic techniques for the treatment of acetabular chondral lesions in femoroacetabular impingement. Int Orthop. 2014;38(10):2057-64.
-
61Shaikh N, Seah MKT, Khan WS. Systematic review on the use of autologous matrix-induced chondrogenesis for the repair of articular cartilage defects in patients. World J Orthop. 2017;8(7):588.
-
62Gao L, Orth P, Cucchiarini M, Madry H. Autologous Matrix-Induced Chondrogenesis: a Systematic Review of the Clinical Evidence. Am J Sports Med. 2019;47(1):222-31.
-
63Volz M, Schaumburger J, Frick H, Grifka J, Anders S. A randomized controlled trial demonstrating sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop. 2017;41(4):797-804.
-
64Anders S, Volz M, Frick H, Gellissen J. A Randomized, Controlled Trial Comparing Autologous Matrix-Induced Chondrogenesis (AMIC®) to Microfracture: Analysis of 1- and 2-Year Follow-Up Data of 2 Centers. Open Orthop J. 2013;7(Suppl 4):133-43.
-
65Vanlauwe J, Saris DBF, Victor J, Almqvist KF, Bellemans J, Luyten FP. Five-year outcome of characterized chondrocyte implantation versus microfracture for symptomatic cartilage defects of the knee: early treatment matters. Am J Sports Med. 2011;39(12):2566-74.
-
66Saris D, Price A, Widuchowski W, Bertrand-Marchand M, Caron J, Drogset JO, et al.; SUMMIT study group. Matrix-Applied Characterized Autologous Cultured Chondrocytes Versus Microfracture: Two-Year Follow-up of a Prospective Randomized Trial. Am J Sports Med. 2014;42(6):1384-94.
-
67Bentley G, Biant LC, Vijayan S, Macmull S, Skinner JA, Carrington RWJ. Minimum ten-year results of a prospective randomised study of autologous chondrocyte implantation versus mosaicplasty for symptomatic articular cartilage lesions of the knee. J Bone Joint Surg Br. 2012;94(4):504-9.
-
68Dhollander AA, De Neve F, Almqvist KF, Verdonk R, Lambrecht S, Elewaut D, et al. Autologous matrix-induced chondrogenesis combined with platelet-rich plasma gel: technical description and a five pilot patients report. Knee Surg Sport Traumatol Arthrosc. 2011;19(4):536-42.
-
69Knecht S, Erggelet C, Endres M, Sittinger M, Kaps C, Stussi E. Mechanical testing of fixation techniques for scaffold-based tissue-engineered grafts. J Biomed Mater Res B Appl Biomater. 2007;83(1):50-7.
-
70Hunziker EB, Stahli A. Surgical suturing of articular cartilage induces osteoarthritis-like changes. Osteoarthr Cartil. 2008;16(9):1067-73.
-
71Friedman JM, Sennett ML, Bonadio MB, Orji KO, Neuwirth AL, Keah N, et al. Comparison of Fixation Techniques of 3D-Woven Poly(ϵ-Caprolactone) Scaffolds for Cartilage Repair in a Weightbearing Porcine Large Animal Model. Cartilage. 2018;9(4):428-37.
-
72Welsch GH, Mamisch TC, Zak L, Blanke M, Olk A, Marlovits S, Trattnig S. Evaluation of cartilage repair tissue after matrix-associated autologous chondrocyte transplantation using a hyaluronic-based or a collagen-based scaffold with morphological MOCART scoring and biochemical T2 mapping: preliminary results. Am J Sports Med. 2010 May;38(5):934-42.
-
73Erickson IE, Kestle SR, Zellars KH, Farrell MJ, Kim M, Burdick JA, Mauck RL. High mesenchymal stem cell seeding densities in hyaluronic acid hydrogels produce engineered cartilage with native tissue properties. Acta Biomater. 2012 Aug;8(8):3027-34.
-
74Wu SC, Chang JK, Wang CK, Wang GJ, Ho ML. Enhancement of chondrogenesis of human adipose derived stem cells in a hyaluronan-enriched microenvironment. Biomaterials. 2010;31(4):631-40.
-
75Gao L, Orth P, Cucchiarini M, Madry H. Effects of solid acellular type-I/III collagen biomaterials on in vitro and in vivo chondrogenesis of mesenchymal stem cells. Expert Rev Med Devices. 2017;14(9):717-32.
-
76Almeida HV, Sathy BN, Dudurych I, Buckley CT, O’Brien FJ, Kelly DJ. Anisotropic Shape-Memory Alginate Scaffolds Functionalized with Either Type I or Type II Collagen for Cartilage Tissue Engineering. Tissue Eng Part A. 2017;23(1-2):55-68.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Actualización en el tratamiento de las úlceras condrales de la rodilla
- Comparación de la inyección intraarticular de plasma rico en plaquetas (PRGF®) y ácido hialurónico (Hyalone®) en el tratamiento de las lesiones condrales: estudio clínico prospectivo aleatorizado
- Microfracturas o estimulación de la médula ósea (BMS): la evolución de la técnica
- Injerto de cartílago en fresco. Indicaciones, técnica quirúrgica y evidencia científica
- Condrogénesis inducida por matrices (AMIC)
- Instant CEMTRO Cell (ICC), implante de condrocitos autólogos de alta densidad
- Regenerar el cartílago articular: perspectivas y futuro
- Cirugía de implante de condrocitos autólogos en rodilla
- Úlceras condrales de espesor completo en rótula y cóndilo femoral de rodilla
Más en PUBMED
Más en Google Scholar
Más en ORCID


Revista Española de Artroscopia y Cirugía Articular está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.