Pseudoartrosis séptica. Actualización en manejo y tratamiento
Septic non-union. Management and treatment update
Resumen:
La pseudoartrosis séptica continúa siendo un reto para los cirujanos ortopédicos. La unión de la falta de consolidación de una fractura a un proceso infeccioso hace de esta entidad una patología cuya resolución es altamente compleja y que requiere un abordaje multidisciplinar. El auge de las técnicas de síntesis de fracturas ha llevado aparejado un incremento en los índices de procesos infecciosos que ralentizan e incluso detienen el proceso normal de curación de la fractura.
En el presente artículo se realiza una actualización de la problemática de este tipo de fracturas con especial hincapié en las diferentes opciones terapéuticas de este tipo de patología.
Abstract:
Septic non unions are rare and often occurs after an open fracture. Internal fixation is getting more and more popular, but it’s a procedure at risk because of the high rate of infection.
The treatment of septic non-unions needs a multidisciplinary approach to treat properly both non union and infection of bone and soft tissues.
The aim of this study is to outline the current thoughts and recommendations for the management of septic non-union.
Introducción
No existe un consenso universal sobre el momento en el cual una fractura ha perdido su capacidad de unión de fragmentos y pasa a denominarse pseudoartrosis. En términos generales, se acepta que, si no existen criterios de unión entre fragmentos a los 6-8 meses, nos hallaremos ante una pseudoartrosis que requiere gestos adicionales para conseguir la consolidación de la fractura(1,2).
No hay que confundir este término, en el que hay que realizar gestos médicos/quirúrgicos, con el retardo de la consolidación, en el que el proceso de curación de la fractura se llevará a cabo en un plazo mayor al esperado para el tipo y la localización de la misma, siendo necesaria, en algunas ocasiones, la realización de gestos terapéuticos asociados. Ahí radica la diferencia con la pseudoartrosis, en la que es necesario siempre asociar nuevos tratamientos para garantizar la consolidación de la fractura.
La pseudoartrosis se ha definido clásicamente como la ausencia de consolidación de una fractura creándose una falsa articulación al nivel del foco, con cierre del canal medular, esclerosis de bordes, presencia de pseudocápsula y, en algunas ocasiones, movilidad anómala al nivel de la fractura. Sin embargo, la ausencia de estos signos no descarta la existencia de una pseudoartrosis.
La incidencia de pseudoartrosis varía entre un 3 y un 10% de las fracturas según las series, con una media de 1,5 intervenciones para pseudoartrosis asépticas y 3,4 intervenciones para las infectadas, lo que supone un importante gasto sanitario en su tratamiento(3). Sus localizaciones más frecuentes son: tibia, fémur y húmero(4).
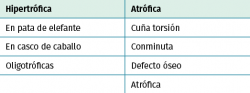
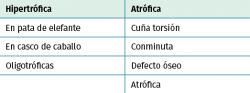
Existen múltiples clasificaciones de pseudoartrosis. La más empleada, en función de la viabilidad de los extremos, es la que propusieron Judet y Schweiberer(5) (Tabla 1) en función de los patrones morfológicos, distinguiendo 2 tipos, la hipertrófica y la atrófica.
La clasificación más empleada en los casos de pseudoartrosis séptica es la de Paley(6) (Tabla 2), que se basa en el defecto óseo existente, dividiéndolas en:
- Retardo de consolidación.
- Pseudoartrosis.
Pseudoartrosis séptica
La pseudoartrosis séptica se define como la falta de consolidación de una fractura debida a un proceso infeccioso en el foco(7,8,9,10). La llegada de los gérmenes puede ser secundaria al proceso quirúrgico destinado a la curación o, en la mayoría de las ocasiones, a fracturas abiertas. Con mucha menos frecuencia, la contaminación de la fractura se origina por vía hematógena. El incremento de las indicaciones quirúrgicas para el tratamiento de las fracturas ha supuesto un aumento de los índices de pseudoartrosis sépticas(11).
Las causas que pueden llevar a una fractura a una situación de pseudoartrosis son múltiples y dependen tanto del tipo de fractura como de las características del paciente.
La mayor prevalencia de pseudoartrosis se encuentra en huesos largos, fundamentalmente la tibia y el fémur, seguidos por el húmero y el radio, siendo el lugar habitual de asiento de la pseudoartrosis la región diafisaria, desde el tercio medio hasta el tercio distal del hueso(5). La hipótesis más aceptada propone una etiología vascular(12)
Diagnóstico
Siempre que nos encontremos ante un retardo de la consolidación o una pseudoartrosis establecida debemos descartar la existencia de un proceso infeccioso. Para ello, debemos recurrir a la clínica del paciente y a pruebas complementarias que nos orienten hacia una posible infección.
El mecanismo traumático y el tipo de fractura son importantes, pues una fractura abierta o una fractura de alta energía con importante lesión de las partes blandas supone un riesgo aumentando de infección.
La clínica es fundamental para el diagnóstico. La presencia de un cuadro infeccioso (fiebre, malestar general, náuseas...) asociado a signos infecciosos e inflamatorios al nivel de la fractura o herida quirúrgica (supuración, dehiscencia de la herida...), así como la presencia de un dolor desproporcionado, nos deben orientar hacia un proceso séptico.
La alteración de parámetros analíticos, en concreto los reactantes de fase aguda tales como la velocidad de sedimentación globular (VSG), la proteína C reactiva (PCR) y las cifras de leucocitos nos ayudan a establecer el diagnóstico, así como la evolución de la infección marcando etapas de tratamiento.
Respecto a los estudios de imagen, el patrón radiológico es variable, abarcando desde el atrófico/oligotrófico, donde los extremos de la fractura adquieren un aspecto afilado biológicamente no activo, hasta el hipertrófico, donde existe crecimiento óseo alrededor de la fractura sin llegar a fusionarse. Pueden observarse alteraciones en el patrón óseo normal, como son osteopenia, adelgazamiento de cortical, fragmentos óseos desvitalizados (secuestros), así como alteraciones del periostio y los tejidos blandos circundantes.
El estudio con resonancia magnética nuclear (RMN) es obligatorio y nos informará, en el caso de no existir artefactos por el material de osteosíntesis, de la sospecha de infección, así como de su extensión dentro del propio hueso y de las partes blandas circundantes.
Respecto a los cultivos, conviene recordar la limitada exactitud de las muestras obtenidas en fístulas. Se aconseja obtener un mínimo de 5 muestras que deben abarcar el hueso, las partes blandas y el material purulento, siendo recomendable la obtención de estas antes de iniciar el tratamiento antibiótico. La positividad en el cultivo de 2 o más muestras establece el diagnóstico de certeza de infección. Asimismo, es recomendable el envío de muestras óseas para su estudio anatomopatológico para confirmar la presencia de osteítis crónica(13). El patógeno más frecuentemente aislado en estas muestras en todos los grupos etarios es el Staphylococcus aureus.
Los estudios con gammagrafía (galio, leucocitos marcados…) pueden ayudarnos a establecer el diagnóstico. El empleo de tecnecio (Tc) como radiotrazador ofrece una alta sensibilidad, pero escasa especificidad. En cambio, el indio 111 como marcador tiene una especificidad del 93%(14).
Manejo y tratamiento
Se trata, como hemos dicho, de un auténtico reto para el cirujano ortopédico, pues nos encontramos ante una patología con evolución tórpida y tendencia a la cronicidad que requiere de un tratamiento largo y complejo con alto riesgo de recaídas. El tratamiento es en todos los casos un tratamiento multidisciplinar, en el cual se ven inmersos especialistas en medicina interna, cirugía plástica, traumatología...(15).
A la hora de abordar el tratamiento hay que tener en cuenta que hay factores sistémicos propios del paciente que influyen en la aparición y la evolución de una pseudoartrosis infectada. La presencia de comorbilidades como diabetes o enfermedades que alteren el sistema inmunitario, el uso de determinados fármacos como los corticoides, los anticoagulantes orales, los antiinflamatorios no esteroideos (AINE), tratamientos con quimioterapia o radioterapia local, así como la existencia de hábitos tóxicos como el consumo excesivo de alcohol o tabaquismo, son factores de riesgo para el desarrollo y una mala evolución de esta enfermedad(10).
Respecto a los factores locales, el estado de las partes blandas y el estado vascular de la extremidad son de vital importancia para la planificación terapéutica. Una buena cobertura del área de la pseudoartrosis infectada nos asegurara un buen aporte vascular y, por tanto, la llegada del antibiótico.
Deberemos, asimismo, evaluar correctamente la virulencia, la sensibilidad y la resistencia del germen implicado.
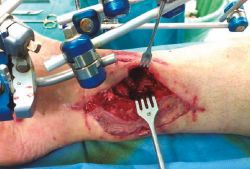
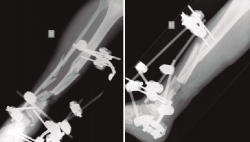
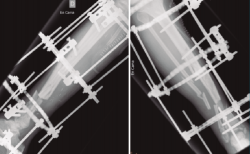
Una vez establecido el diagnóstico, el tratamiento será, si las condiciones del paciente lo permiten, fundamentalmente quirúrgico (Figuras 1 a 4).
figura4.png
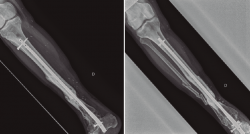
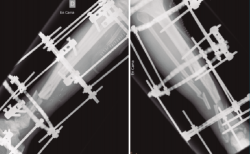
Figura 4. Una vez confirmada la erradicación de la infección, se procedió a la retirada del fijador externo. Se realizó un aporte de injerto óseo autólogo procedente de la tabla interna de la tibia y una posterior fijación interna de la fractura mediante una artrodesis de tobillo. El resultado final fue una correcta consolidación de la fractura.
El objetivo primordial es la esterilización del foco de fractura y la correspondiente consolidación de la misma, prestando especial atención al manejo de las partes blandas.
Si bien han sido múltiples los tratamientos descritos a lo largo de la historia para la pseudoartrosis séptica, la tendencia actual es a dividirlo en 2 etapas:
Primera fase
Dentro de la primera fase incluimos el desbridamiento del foco, el relleno de cavidades, la estabilización ósea y la cobertura o reconstrucción de las partes blandas.
Desbridamiento del foco
Se procederá a la retirada del material de síntesis, la resección de los secuestros óseos si los presentara y la cruentación del hueso en ambos extremos de la pseudoartrosis hasta llegar a un hueso sano sangrante. Este procedimiento ha de ser todo lo agresivo que sea necesario, pues el objetivo es obtener unos márgenes limpios en los extremos óseos y en el tejido circundante(16).
En cuanto a las partes blandas, se deben retirar todas aquellas fístulas y partes blandas desvitalizadas o necróticas.
Este método de limpieza del foco se puede realizar tantas veces como se considere necesario hasta tener la certeza de la completa eliminación de la infección ósea y de las partes blandas.
Relleno de cavidades
Es habitual encontrar una zona de defecto óseo. En tal caso, existen múltiples alternativas para su relleno. Habitualmente se suele emplear cemento óseo de polimetilmetacrilato (PMMA)(17) impregnado en antibiótico (habitualmente gentamicina y vancomicina, aunque también es posible el uso de penicilinas o clindamicina).
Con ello buscamos, por un lado, la estabilidad que otorga el cemento y, por otro, crear altas concentraciones de antibiótico en el foco de la fractura (hasta 200 veces más que con antibiótico sistémico). Como inconveniente presenta su corta duración (un máximo de 10 días) y su reciente asociación a un aumento del riesgo de aparición de biofilm que puede complicar la evolución de la infección(18).
Otra alternativa terapéutica para el relleno de cavidades son los vidrios bioactivos, cuyo mecanismo de acción se basa en producir un cambio del pH local produciendo, por un lado, una inhibición del crecimiento bacteriano y, por otro, una acción osteogénica(19).
Respecto al empleo, en esta primera fase, de injerto u otros sustitutos óseos, solo es posible cuando tengamos la certeza de haber eliminado por completo la infección mediante el desbridamiento inicial, algo prácticamente imposible.
Estabilización ósea
La estabilidad entre los extremos es básica para erradicar la infección. Aunque la estabilización del segmento óseo se puede realizar mediante yeso, los fijadores externos adquieren aquí un papel fundamental. El emplazamiento de los pines, alejados del foco, y la capacidad de los fijadores de crear movimientos añadidos a la estabilidad, como son la compresión y la distracción, hacen de este tipo de tratamiento el ideal para el manejo terapéutico de las pseudoartrosis sépticas(11,13,15). Otra de las ventajas de la fijación externa es que se trata de una técnica poco invasiva, que no altera los tejidos blandos circundantes a la pseudoartrosis y compatible con posibles cirugías posteriores(14).
Fue el profesor A. Ilizarov quien popularizó el empleo de fijadores externos en el tratamiento de la pseudoartrosis séptica; más concretamente, empleó un sistema de fijación externa circular diseñado por él, que combinaba movimientos de distracción con movimientos de compresión sobre el foco(13,20,21,22,23).
El empleo de otros materiales de osteosíntesis como tornillos o placas se debe realizar solo de forma excepcional y con carácter temporal(14,24), pues requiere la certeza de que la infección ha sido erradicada.
Reconstrucción y cobertura de las partes blandas
Como ya hemos indicado, tenemos que asegurar una buena cobertura de la piel y las partes blandas para garantizar el éxito del tratamiento, empleando, en caso necesario, injertos y colgajos.
Tras esta primera fase, se completará un ciclo de antibioterapia específica guiada por los resultados de los cultivos obtenidos. La duración de este periodo no se puede precisar con certeza, pero habitualmente será de unas 6 semanas. Factores como la virulencia del germen responsable de la infección, el estado inmunitario del paciente, la cobertura de las partes blandas que asegure la llegada del antibiótico… serán determinantes a la hora de establecer el tiempo necesario de empleo del antibiótico entre fases. Cuando la evolución clínica y las pruebas de imagen, junto a la normalización de los parámetros analíticos, nos sugieran la erradicación de la infección, se procederá a un segundo tiempo quirúrgico, con la extracción del cemento, una cirugía reconstructiva del defecto óseo si lo hubiera y el tratamiento definitivo de la fractura.
Segunda fase
En este segundo tiempo, se realizará una cirugía reconstructiva del defecto óseo y, si fuera necesario, de las partes blandas.
Las técnicas más empleadas para ello son:
• Injerto óseo (auto/aloinjerto):
– Decorticación.
– Papineau.
– Masquelet.
– Injerto óseo vascularizado (peroné vascularizado).
– Aloinjertos óseos.
• Transporte óseo:
– Osteogénesis a distracción (principio Ilizarov).
Respecto a las indicaciones del empleo de una u otra técnica, conviene recordar que, de forma general, las 3 primeras técnicas se emplean en casos de defectos óseos menores, reservando los aloinjertos, el injerto óseo vascularizado mediante peroné y la osteogénesis a distracción para defectos óseos de mayor tamaño.
Conviene recordar, asimismo, que estas 2 últimas son técnicamente más exigentes.
Injerto óseo
El clásico método de Papineau fue descrito por el autor en 1971(25) y empleado para defectos óseos menores. Consiste en, una vez realizado el desbridamiento del foco de pseudoartrosis y transcurrido el periodo necesario para la esterilización del foco, rellenar la cavidad con injerto óseo autólogo dejando expuesto el lecho, que se cubre con gasas impregnadas en vaselina. El cierre de las partes blandas se logra de forma espontánea o con ayuda de injerto. En los últimos años se ha popularizado por sus buenos resultados el empleo de la terapia de vacío (VAC) para esta técnica(26,27,28,29,30,31).
La técnica de Masquelet se basa en la capacidad biológica de la membrana creada tras el empleo de cemento que rellena el espacio originado tras el correspondiente desbridamiento óseo. Esta membrana, compuesta por colágeno de tipo I y una densa matriz de fibroblastos, contiene una alta concentración de factores osteogénicos. En la segunda fase del tratamiento, se abre esta membrana, se extrae el cemento y se coloca injerto óseo autólogo, cerrándola de nuevo. Los defensores de esta técnica mantienen que la membrana protege la reabsorción ósea del injerto autólogo, aportando factores de crecimiento y vascularización, y previniendo la interposición de tejidos blandos(32).
Dentro del grupo de los injertos óseos vascularizados, destaca el injerto de peroné, descrito por Taylor mediante técnicas de microcirugía en 1975(33). Se emplea para defectos óseos mayores de 6 cm. Entre sus ventajas encontramos que, al poseer su propia irrigación, no depende de los tejidos vecinos para su nutrición.
Además, permite conservar la longitud y es un hueso resistente. Puede incluir, además de hueso, músculo, fascia y piel. Está particularmente indicado en el antebrazo, el húmero y la tibia. Como inconveniente, depende de la calidad vascular de los tejidos vecinos y de la calidad del injerto obtenido. Asimismo, se trata de un procedimiento técnicamente complejo y prolongado en caso de emplearlo para huesos de carga(34).
Los aloinjertos óseos estructurales, ampliamente utilizados, presentan el inconveniente, sobre todo los diafisarios, de su difícil consolidación en el tejido óseo huésped.
Trasporte óseo. Osteogénesis a distracción (principio Ilizarov)
En la actualidad se considera el estándar de tratamiento para los defectos óseos en determinadas localizaciones anatómicas.
El concepto de osteogénesis a distracción fue descrito por Ilizarov en la década de los cincuenta, basado en la capacidad de generar hueso y tejidos blandos cuando se desliza un fragmento de hueso previamente individualizado. La técnica básica consiste en la colocación de un fijador externo, circular o monolateral, y la posterior realización de una osteotomía (corticotomía percutánea que respete al máximo el periostio y la medular), habitualmente en el área metafisaria. Tras un periodo de latencia, el fragmento es transportado de forma longitudinal tutorizado por el fijador externo, a un ritmo, habitualmente, de 0,25 mm/6 h, hasta la toma de contacto con el otro extremo. El defecto óseo creado se va rellenando mediante una osificación espontánea, progresiva, en la zona de distracción(20). En defectos óseos menores, se puede resolver de forma directa, es decir, estableciendo contacto y síntesis entre ambas superficies óseas para, si fuese necesario, realizar con posterioridad un alargamiento de la extremidad(35). Sin embargo, este método no está exento de complicaciones, entre las que destaca el largo periodo de tiempo necesario para conseguir la formación de hueso y su maduración (en muchos casos, superior al año), problemas en el contacto del hueso transportado con el hueso que lo recibe, desalineación en eje secundaria, incomodidad al mantener fijadores durante periodos prolongados...
Incluso en tratamientos llevados a cabo con éxito, donde se ha conseguido eliminar la infección y la consolidación de la pseudoartrosis séptica, habrá que realizar un cuidadoso seguimiento del paciente, pues son frecuentes las recaídas.
Por último, dentro de las opciones de tratamiento hay que recordar el papel de la amputación de la extremidad en los casos más difíciles y donde se prevea una mala evolución del cuadro.
Prevención
Sin duda, uno de los capítulos más importantes de las pseudoartrosis infectadas es el de la prevención. La primera premisa pasa por la realización de una correcta indicación quirúrgica. El constante crecimiento de las técnicas ha llevado al cirujano ortopédico a una sobreindicación quirúrgica. Identificar los factores de riesgo en determinados pacientes nos harán mantenernos alerta durante todo el tratamiento. Hay que prestar especial atención a las fracturas abiertas y de alta energía, requiriendo ambas un tratamiento minucioso desde el primer momento y una estrecha vigilancia.
Una vez en el quirófano, es fundamental una técnica cuidadosa con máximo respeto de las partes blandas y el hueso, así como una estabilización correcta de la fractura y un posterior seguimiento adecuado de la misma.
La aparición de alteraciones en el normal discurrir de una fractura intervenida o la presencia de alguno de los signos de alarma antes referidos nos exigirán actuaciones rápidas para intentar evitar la cronicidad del cuadro.
Tablas
Figuras
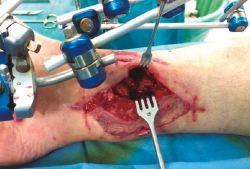
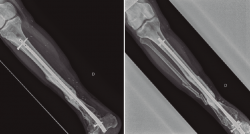
Figura 1. Paciente con fractura del tercio distal de la tibia de tipo Gustilo IIIC que se trató inicialmente con fijador externo.
Figura 2. Pasados 6 meses, se observa ausencia de consolidación de la fractura. El paciente presentaba además supuración de pines distales y clínica infecciosa.
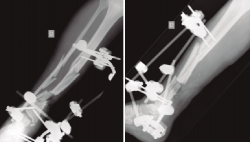
Figura 3. Rescate de la fractura mediante fijador externo de tipo Ilizarov, empleado como tratamiento puente antes del tratamiento definitivo.
Figura 4. Una vez confirmada la erradicación de la infección, se procedió a la retirada del fijador externo. Se realizó un aporte de injerto óseo autólogo procedente de la tabla interna de la tibia y una posterior fijación interna de la fractura mediante una artrodesis de tobillo. El resultado final fue una correcta consolidación de la fractura.
Información del artículo
Cita bibliográfica
Autores
Cristina Delgado del Caño
Unidad de Traumatología. Hospital Monográfico Asepeyo Coslada. Madrid
Hospital Universitario Fundación Jiménez Díaz. Madrid
José García López
Unidad de Fijación Externa. Hospital Asepeyo Coslada. Madrid
Unidad de Traumatología. Hospital Monográfico Asepeyo Coslada. Madrid
Ricardo Rodríguez de Oya
Unidad de Traumatología. Hospital Monográfico Asepeyo Coslada. Madrid
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Financiación. Los autores declaran que este trabajo no ha sido financiado.
Conflicto de interés. Los autores declaran no tener ningún conflicto de intereses.
Referencias bibliográficas
-
1Meyer S, Weiland AJ, Willenegger H. The treatment of infected non-union of fractures of long bones. Study of sixty-four cases with a five to twenty-one-year follow-up. J Bone Joint Surg Am. 1975;57(6):836-42.
-
2Struijs PAA, Poolman RW, Bhandari M. Infected nonunion of the long bones. J Orthop Trauma. 2007;21(7):507-11.
-
3Hak DJ, Fitzpatrick D, Bishop JA, Marsh JL, Tilp S, Schnettler R, et al. Delayed union and nonunions: epidemiology, clinical issues, and financial aspects. Injury. 2014;45 Suppl 2:S3-7.
-
4Pérez S, Escarpanter JC, Cevallos A. Diagnóstico morfológico funcional: aplicación práctica en pseudoartrosis diafisarias. 1992.
-
5Pelser P. Management of septic non-unions. SA Orthopaedic Journal. 2009;8(2):29-34.
-
6Paley D, Catagni MA, Argnani F, Villa A, Benedetti GB, Cattaneo R. Ilizarov treatment of tibial nonunion with bone loss. Clin Orthop Relat Res. 1989 Apr;(241):146-65.
-
7Buliés E, C J. Factores de riesgo para la aparición de seudoartrosis en las fracturas diafisarias. Revista Cubana de Ortopedia y Traumatología. 1997;11(1-2):50-5.
-
8Rüter A, Mayr E. [Pseudarthrosis]. Chirurg. 1999;70(11):1239-45.
-
9Audigé L, Griffin D, Bhandari M, Kellam J, Rüedi TP. Path analysis of factors for delayed healing and nonunion in 416 operatively treated tibial shaft fractures. Clin Orthop Relat Res. 2005;438:221-32.
-
10Rodríguez-Merchán EC, Forriol F. Nonunion: general principles and experimental data. Clin Orthop Relat Res. 2004;(419):4-12.
-
11Toh CL, Jupiter JB. The infected nonunion of the tibia. Clin Orthop Relat Res. 1995;(315):176-91.
-
12Bosch U, Skutek M, Kasperczyk WJ, Tscherne H. [Nonunion of the humeral diaphysis - operative and nonoperative treatment]. Chirurg. 1999;70(11):1202-8.
-
13Motsitsi NS. Management of infected nonunion of long bones: the last decade (1996-2006). Injury. 2008;39(2):155-60.
-
14Campbell cirugía ortopédica. Fracturas. Luxaciones. Trastornos traumáticos de las articulaciones. Artroscopia. Vol. 2. Médica Panamericana; 1993. p. 15.
-
15Cierny G. Infected tibial nonunions (1981-1995). The evolution of change. Clin Orthop Relat Res. 1999;(360):97-105.
-
16Tetsworth K, Cierny G. Osteomyelitis debridement techniques. Clin Orthop Relat Res. 1999;(360):87-96.
-
17Carbó-Laso E, Sanz-Ruiz P, del Real-Romero JC, Ballesteros-Iglesias Y, Paz-Jiménez E, Arán-Ais F, et al. Nuevo método de liberación de antibióticos del cemento óseo (polimetilmetacrilato): redefiniendo los límites. Rev Esp Cir Ortop Traumatol. 2018;62(1):86-92.
-
18Hernández Cortés P, Ramírez Tabernero V, Acosta González FL. Repercusiones biológicas del cemento óseo de polimetilmetacrilato. Rev Soc Andaluza Traumatol Ortop. 1999;19(1):33-43.
-
19Välimäki VV, Aro HT. Molecular basis for action of bioactive glasses as bone graft substitute. Scand J Surg. 2006;95(2):95-102.
-
20Ilizarov GA. [Basic principles of transosseous compression and distraction osteosynthesis]. Ortop Travmatol Protez. 1971;32(11):7-15.
-
21Gubin AV, Borzunov DY, Marchenkova LO, Malkova TA, Smirnova IL. Contribution of G.A. Ilizarov to bone reconstruction: historical achievements and state of the art. Strat Trauma Limb Reconstr. 2016;11(3):145-52.
-
22Jenny G, Jenny JY, Mosser JJ. Ilizarov’s method in infected tibial pseudarthrosis and for reconstruction of bone defect. Orthop Traumatol. 1993;3(1):55-8.
-
23Gubin AV, Borzunov DY, Malkova TA. The Ilizarov paradigm: thirty years with the Ilizarov method, current concerns and future research. Int Orthop. 2013;37(8):1533-9.
-
24Rodríguez-Merchán EC, Gómez-Castresana F. Internal fixation of nonunions. Clin Orthop Relat Res. 2004;(419):13-20.
-
25Papineau LJ. L’excision-greffe avec fermeture retardee deliberee dans l’osteomyelite chronique. Nouv Presse Med. 1973;2:2753-5.
-
26Archdeacon MT, Messerschmitt P. Modern Papineau technique with vacuum-assisted closure. J Orthop Trauma. 2006;20(2):134-7.
-
27Papineau LJ, Alfageme A, Dalcourt JP, Pilon L. Ostéomyélite chronique: excision et greffe de spongieux à l’air libre après mises à plat extensives. Int Orthop. 1979;3(3):165-76.
-
28Roy-Camille R, Guillamon JL, Saillant G, Sagnet P, Lelievre JF, Reignier B. Traitement de l’ostéite par l’excision-greffe à ciel ouvert selon la méthode de Papineau. Chirurgie. 1974;100(7):480-7.
-
29Panda M, Ntungila N, Kalunda M, Hinsenkamp M. Treatment of chronic osteomyelitis using the Papineau technique. Int Orthop. 1998;22(1):37-40.
-
30Hernández Sampelayo Matos T, Zarzoso Fernández S, Navarro Gómez ML, Santos Sebastián MM, González Martínez F, Saaveda Lozano J. Osteomielitis y artritis séptica. Protocolos Diagnóstico Terapéuticos de la AEP: Infectología Pediátrica. AEP; 2008.
-
31Fisher A, Brady B. Vacuum Assisted Wound Closure Therapy. Issues Emerg Health Technol. 2003 Mar;(44):1-6.
-
32Masquelet AC, Fitoussi F, Begue T, Muller GP. [Reconstruction of the long bones by the induced membrane and spongy autograft]. Ann Chir Plast Esthet. 2000;45(3):346-53.
-
33Taylor GI, Miller GD, Ham FJ. The free vascularized bone graft. A clinical extension of microvascular techniques. Plast Reconstr Surg. 1975;55(5):533-44.
-
34Malizos KN, Zalavras CG, Soucacos PN, Beris AE, Urbaniak JR. Injertos libres vascularizados de peroné para reconstruir defectos óseos. J Am Acad Orthop Surg. 2004;2:432-41.
-
35Martí González, GC, López de Arriba Gárate, F. Transporte óseo. Rev Esp Cir Osteoart. 1992;27:183-7.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Juntos, avanzamos y crecemos
- Seguimos adelante
- La infección asociada a la asistencia sanitaria en el entorno laboral
- Infección aguda en fractura tratada con osteosíntesis
- Artritis séptica de rodilla tras artroscopia de reconstrucción de ligamento cruzado anterior
- Pseudoartrosis séptica. Actualización en manejo y tratamiento
- Osteítis crónica
- Clínica Online: una herramienta útil para profesionales sanitarios y pacientes en medicina laboral
- Terapia de presión negativa con instilación en pacientes traumatológicos
- Propuesta de un protocolo de abordaje fisioterapéutico en pacientes en situación de baja laboral pendientes de intervención quirúrgica
- Análisis de la eficacia sobre el dolor y la capacidad funcional en el abordaje terapéutico de la epicondilopatía lateral crónica del codo con ondas de choque extracorpóreas radiales
- Plastia de rotación del ancóneo: una opción de rescate tras cirugía en epicondilitis crónica rebelde al tratamiento
- Accidente por electrización. ¡Estoy vivo!
Más en PUBMED
Más en Google Scholar


Revista Española de Traumatología Laboral está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.