Lesiones parciales del ligamento cruzado anterior
Partial tears of the anterior cruciate ligament
Resumen:
Las lesiones parciales del ligamento cruzado anterior (LCA) siguen representando un dilema diagnóstico y terapéutico para el cirujano ortopédico. Aunque son lesiones poco frecuentes, pueden ser sintomáticas y condicionar un trastorno funcional significativo. A la hora de realizar un diagnóstico correcto, además de la historia clínica y los estudios de imagen, la exploración física mediante la maniobra del pivot shift, tanto en la consulta como bajo anestesia, es clave a la hora de valorar la inestabilidad funcional del LCA y el tratamiento más adecuado. En la actualidad, las técnicas quirúrgicas anatómicas individualizadas permiten la reconstrucción artroscópica del fascículo lesionado. Estas técnicas preservan las fibras intactas con el objetivo de restaurar la anatomía del LCA y muestran buenos resultados funcionales. Recientemente, se han desarrollado técnicas de reparación y aumentación del fascículo lesionado en un intento de lograr una cicatrización estable del mismo. El propósito de esta revisión es clarificar el manejo clínico y la estrategia de tratamiento en las roturas parciales del LCA.
Abstract:
Partial injuries of the anterior cruciate ligament (ACL) continue to represent a diagnostic and therapeutic dilemma for the orthopedic surgeon. Although they are uncommon injuries, they could be symptomatic and condition a significant functional impairment. To make a correct diagnosis of partial ACL injuries, in addition to the clinical history and imaging studies, the physical examination mainly by means of the pivot shift maneuver, both in the office and under anesthesia, is key in assessing functional instability of the ACL and to select the most appropriate treatment. Currently, individualized anatomical surgical techniques allow arthroscopic reconstruction of the injured fascicle. These techniques preserve the intact fibers and restore the anatomy of the ACL with good functional results. Recently, techniques of repair and augmentation of the injured fascicle have been developed in an attempt to achieve stable healing of it. The purpose of this review is to clarify the clinical management and treatment strategy in partial ACL tears.
Introducción
Las roturas parciales del ligamento cruzado anterior (LCA) son menos frecuentes que las roturas completas, representando aproximadamente de un 10 a un 27% de las lesiones del LCA(1).
Las roturas parciales del LCA constituyen un importante reto diagnóstico. El diagnóstico clínico es difícil y la fiabilidad diagnóstica de la resonancia magnética (RM) es menor que en las lesiones completas. Maniobras clínicas como el pivot shift y protocolos de RM adaptados son necesarios para un diagnóstico preciso de las lesiones parciales del LCA(1).
La importancia de estas lesiones reside en que pueden condicionar inestabilidad clínica o subclínica y estar en el origen de una pérdida de capacidad funcional y de daño articular.
El tratamiento en casos sin inestabilidad puede ser conservador, pero un porcentaje significativo de las lesiones parciales puede progresar a completas y condicionar inestabilidad significativa(2). En los últimos años, la evolución de los tratamientos biológicos y de las plastias de reconstrucción unifascicular ha cambiado significativamente el abordaje terapéutico de estas lesiones(2).
Revisamos el estado actual del diagnóstico clínico, del diagnóstico con RM y del planteamiento terapéutico. Finalmente, se describen brevemente alternativas terapéuticas en pleno desarrollo que plantean nuevas expectativas en un futuro próximo.
Anatomía
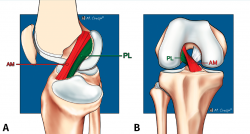
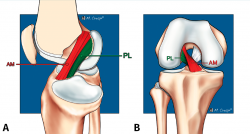
El LCA se origina en el margen medial del cóndilo femoral lateral y está formado por 2 fascículos bien diferenciados, denominados anteromedial (AM) y posterolateral (PL), en función de sus inserciones tibiales(1) (Figura 1).
Estudios biomecánicos han demostrado que ambos haces contribuyen de forma sinérgica a la estabilidad de la rodilla en todo el rango de movimiento de la articulación. Sin embargo, cada fascículo tiene una función diferente: las fibras del fascículo AM se tensan en flexión, mientras que las fibras del fascículo PL se tensan en extensión limitando la traslación tibial anterior. El fascículo PL tiene también una función importante en la restricción de la rotación tibial(1,2).
Definición
Actualmente, no existe consenso en la definición de las roturas parciales del LCA. Para algunos autores se definen como una afectación menor del 50% del ligamento(2) o aquellas lesiones que afectan a solo 1 de los 2 fascículos(3). También existen definiciones multifactoriales que se basan en la combinación de criterios clínicos y artroscópicos, como por ejemplo un test de Lachman positivo con tope firme, pero con mayor laxitud que la rodilla contralateral, sumado a hallazgos artroscópicos de rotura parcial(4).
Diagnóstico clínico
El diagnóstico de las roturas parciales del LCA sigue siendo un importante reto. Se basa en la combinación del diagnóstico clínico, RM y artroscopia.
En primer lugar, se debe realizar una adecuada historia clínica para conocer el mecanismo lesional. Las lesiones parciales del LCA suelen producirse en varones jóvenes (20-30 años) por giros de rodilla durante la práctica deportiva. Debido a sus características biomecánicas, las lesiones del fascículo PL ocurren con la rodilla en hiperextensión y en mecanismos de torsión, mientras que la afectación del fascículo AM ocurre con la rodilla en flexión y traumatismos de mayor energía(3). En la exploración física se deben realizar las maniobras del cajón anterior, Lachman y pivot shift, interpretando los resultados de forma minuciosa, ya que en muchos casos estas maniobras son negativas o discretamente positivas(3). Generalmente, se obtiene un test de Lachman o un cajón anterior positivos con tope firme y un pivot shift negativo(4). En pacientes con maniobras de Lachman y pivot shift positivas y con cajón anterior negativo se debe pensar en la afectación del fascículo PL, ya que es el principal estabilizador rotacional. Por el contrario, si se observa un cajón anterior positivo con Lachman y pivot shift negativos, se debe sospechar afectación del fascículo AM(3). También se debe sospechar una rotura parcial si solo una de las 2 maniobras son positivas (Lachman o cajón anterior), en comparación con la rodilla sana(5).
La medición de la traslación tibial anterior con diferentes dispositivos ha mostrado que una diferencia mayor de 3 mm con respecto a la rodilla sana es indicativa de rotura del LCA. Si la diferencia es de 3 a 5 mm se considera rotura parcial y completa si es mayor de 5 mm(2).
La exploración artroscópica es la técnica definitiva para confirmar el diagnóstico de rotura parcial del LCA. Un conocimiento preciso de la anatomía del LCA, asociado a una adecuada valoración de la tensión de los fascículos mediante la exploración con el palpador, son esenciales para diferenciar qué fascículo, AM o PL, está lesionado(3). La exploración artroscópica debe realizarse colocando la rodilla en posición de 4, que facilita la visualización y la tensión del haz PL. En la clásica posición en 90°, el fascículo PL queda oculto por detrás del fascículo AM, pudiendo pasar desapercibida una rotura del fascículo PL, salvo que sea retraído con el palpador(6,7).
Hay que tener en cuenta que el haz PL se relaja en flexión y se tensa en extensión, por lo que se debe valorar su tensión con el palpador lo más próximo posible a la extensión para determinar su funcionalidad(8). Adicionalmente, en las roturas agudas se pueden observar signos indirectos de hemorragia(3,8).
Resonancia magnética
La RM es la técnica de imagen de elección en la valoración de las lesiones del LCA(1). La exploración mediante RM del LCA debe realizarse con equipos de alto campo magnético (1,5-3 T) y bobinas específicas multicanal (8-16 elementos).
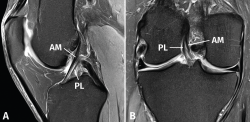
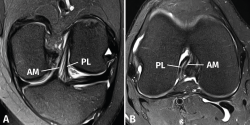
El protocolo de estudio por RM debe incluir secuencias en densidad protónica (DP) con supresión selectiva de la grasa en los 3 planos ortogonales. La valoración del LCA debe realizarse combinando la información de todos los planos. En el plano sagital, con frecuencia resulta complicado diferenciar tanto la anatomía fascicular como la inserción proximal. Los cortes coronales y axiales sucesivos son los más útiles para valorar con precisión la anatomía fascicular y las lesiones parciales del LCA (Figura 2).
figura2.png
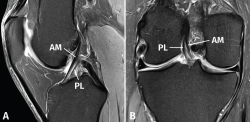
Figura 2. Anatomía normal del ligamento cruzado anterior (LCA) en secuencias convencionales de resonancia magnética (RM). A: corte sagital potenciado en densidad protónica (DP) con supresión grasa que muestra en toda su extensión el trayecto del fascículo anteromedial (AM); B: corte coronal de RM potenciado en DP con supresión grasa que muestra la anatomía bifascicular. PL: fascículo posterolateral.
La RM utilizando un protocolo estándar muestra una sensibilidad y una especificidad del 94% en las roturas del LCA. La fiabilidad diagnóstica es menor en las roturas parciales que en las completas. Los estudios en equipos RM de 3 T muestran una mayor sensibilidad, especificidad y precisión diagnóstica (77, 97 y 95%, respectivamente) que en 1,5 T en el diagnóstico de roturas parciales del LCA(9).
Las secuencias FSE 3D isotrópicas con diferentes nombres comerciales (Space®, Cube®, Vista®, MPV®...) permiten realizar reconstrucciones multiplanares, incluyendo planos oblicuos adaptados al trayecto del LCA(10,11,12,13,14). Estudios recientes muestran que estas secuencias tienen una precisión similar a las secuencias 2D convencionales en la valoración de las lesiones intraarticulares de rodilla. Sin embargo, las imágenes reconstruidas con estas secuencias FSE 3D muestran un mayor grado de distorsión geométrica que dificulta valorar específicamente las lesiones parciales del LCA. La realización de cortes milimétricos oblicuos 2D DP con campo de visión reducido en los planos coronal (siguiendo el trayecto del LCA) y axial (perpendiculares al LCA) permiten obtener imágenes de alta resolución espacial que facilitan una valoración más fiable de las lesiones parciales del LCA(15) (Figura 3).
figura3.png
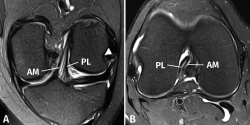
Figura 3. Anatomía normal del ligamento cruzado anterior (LCA) en cortes oblicuos de resonancia magnética (RM). A: corte oblicuo coronal de RM potenciado en densidad protónica (DP) con supresión grasa adaptado al trayecto del LCA que muestra la anatomía bifascicular normal; B: corte oblicuo axial de RM potenciado en DP con supresión grasa perpendicular al trayecto del LCA que permite valorar el estado de ambos fascículos. AM: fascículo anteromedial; PL: fascículo posterolateral.
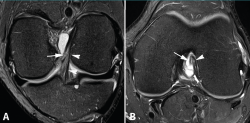
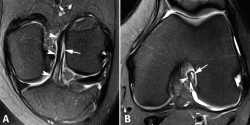
Los hallazgos de RM en las roturas parciales del LCA consisten en un aumento de la señal intrasustancial, defectos focales, distorsión y atenuación de fibras o una orientación anormal del ligamento(1,16) (Figuras 4 y 5). El diagnóstico es más sencillo en fase aguda, por la presencia de signos secundarios con edema y derrame articular. La principal dificultad diagnóstica con RM en la fase aguda consiste en diferenciar roturas parciales de alto grado de completas(1,16).
figura4.png
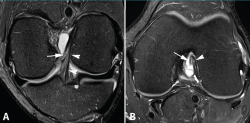
Figura 4. Rotura parcial del fascículo anteromedial (AM) del ligamento cruzado anterior (LCA) con formación de pequeño ganglión en la escotadura intercondílea. Corte oblicuo coronal (A) y axial (B) de resonancia magnética (RM) potenciados en densidad protónica con supresión grasa que muestran una rotura del fascículo AM (flechas). Fascículo posterolateral normal (cabezas de flecha).
El diagnóstico es más complicado en la fase crónica, especialmente en roturas parciales con resinovialización y cicatrización con fijación al ligamento cruzado posterior (LCP) adyacente. Estas lesiones se pueden confundir con frecuencia con lesiones parciales de bajo grado o con un ligamento normal en la RM. En la exploración clínica estos pacientes muestran generalmente menor laxitud con tope firme(1).
figura5.png
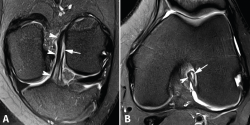
Figura 5. Rotura parcial del fascículo posterolateral (PL) del ligamento cruzado anterior (LCA). Corte oblicuo coronal (A) y axial (B) de resonancia magnética (RM) potenciados en densidad protónica con supresión grasa que muestran una rotura completa proximal del fascículo PL (flechas). Fascículo anteromedial normal (cabezas de flecha).
Ocasionalmente, en la roturas parciales proximales del fascículo AM, el fascículo se dobla en sentido anterior con un aspecto que se define como lesión cíclope o en badajo de campana. Esta lesión puede ser responsable del bloqueo articular, simulando clínicamente un desgarro en asa de cubo(1).
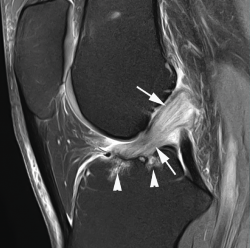
La degeneración mucoide o los gangliones del LCA no deben confundirse con roturas parciales. La degeneración mucoide del LCA muestra unos hallazgos de RM característicos, con un ligamento y una sinovial engrosados de forma difusa con continuidad completa de las fibras. El ligamento muestra una apariencia multifasciculada descrita como imagen en “tallo de apio” y con frecuencia se acompaña de cambios quísticos intraóseos en las zonas de inserción, especialmente en el margen tibial(1) (Figura 6).
figura6.png
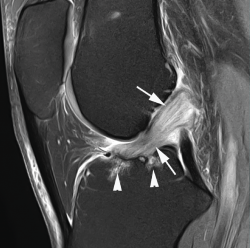
Figura 6. Degeneración mucoide del ligamento cruzado anterior (LCA) . Imagen sagital de resonancia magnética (RM) potenciada en densidad protónica con supresión grasa que muestra engrosamiento y alteración de la señal difusos del ligamento cruzado anterior (flechas) y quistes en la inserción tibial (cabezas de flecha).
Dado que el factor fundamental para decidir entre tratamiento conservador y quirúrgico en estos pacientes es la insuficiencia del LCA y la inestabilidad articular secundaria, algunos autores han intentado clasificar las roturas parciales como estables o inestables en función de los hallazgos de RM(16). Por una parte, parece claro que el riesgo de desarrollar insuficiencia del LCA está relacionado con la severidad de la lesión. La insuficiencia del LCA ocurre en más del 85% de los pacientes con lesión mayor del 75% del ligamento y, por el contrario, en lesiones de menos del 25% del ligamento, el riesgo de desarrollar insuficiencia del LCA es de solo el 12%(8). Por otra parte, el grado de contusión ósea en las lesiones agudas también parece relacionarse con el grado de lesión del LCA(1,16). En las lesiones parciales crónicas, signos de inestabilidad en la RM como la traslación tibial anterior, la falta de soporte tibial del asta posterior del menisco externo y la verticalización u ondulación del LCP se observan únicamente en las roturas inestables.
figura7.png
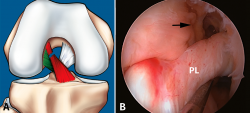
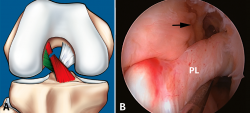
Figura 7. Rotura parcial del fascículo anteromedial (AM). A: esquema que ilustra una rotura parcial del ligamento cruzado anterior (LCA) afectando al fascículo AM; B: imagen artroscópica de la rodilla izquierda desde el portal anterolateral. Rotura completa del fascículo AM (flecha) con un fascículo posterolateral (PL) intacto y tenso a la exploración con el palpador.
Sin embargo, a pesar de estos esfuerzos, la valoración de la actitud terapéutica no se basa en los hallazgos de RM. Si bien la valoración combinada de la exploración clínica y los hallazgos de RM permite establecer una sospecha de inestabilidad en una lesión parcial del LCA, la exploración bajo anestesia con la maniobra de pivot shift sigue siendo el test más fiable en la valoración funcional del LCA y el tratamiento quirúrgico definitivo se debe basar en la exploración artroscópica(17) (Figuras 7 y 8).
figura8.png
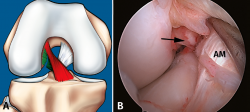
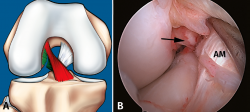
Figura 8. Rotura parcial del fascículo posterolateral (PL). A: esquema que ilustra una rotura parcial del ligamento cruzado anterior (LCA) afectando al fascículo PL; B: visión artroscópica de la rodilla derecha desde el portal anterolateral. Se observa una rotura completa del fascículo PL (flecha), tras la separación con el palpador del fascículo anteromedial (AM).
Tratamiento conservador
El tratamiento conservador “clásico” incluye un periodo de inmovilización en la fase aguda sintomática, seguido de un programa rehabilitador específico y revisiones clínicas periódicas(2,18,19).
Aunque puede parecer prudente el uso inicial de férulas protectoras u ortesis ante el daño intersticial que sufre el LCA, no existe evidencia clara que lo justifique. El protocolo rehabilitador no difiere, en un principio, del utilizado en las roturas completas del LCA tratadas de forma conservadora(2,18,19). En líneas generales, el tratamiento rehabilitador incluye ejercicios de estiramiento, de potenciación del miembro inferior y del core, de propiocepción, de resistencia cardiovascular y ejercicios adaptativos específicos de cada deporte(20,21).
Se precisan revisiones periódicas para valorar el resultado del tratamiento rehabilitador y la laxitud o inestabilidad residual, así como el momento de reincorporación a la actividad deportiva, que habitualmente no será inferior a 3 o 4 meses.
Este tratamiento conservador “clásico”, correctamente indicado, obtiene en diferentes series clínicas buenos resultados, manteniendo o reduciendo ligeramente la actividad física previa y con mínima laxitud residual(22,23,24). Sin embargo, otros autores refieren que estas roturas equivalen funcionalmente a roturas completas y que el tratamiento conservador obtiene resultados pobres a medio o largo plazo(25,26).
En los últimos años, el avance en la ingeniería tisular y la medicina regenerativa ha despertado un creciente interés en nuevas técnicas biológicas de reparación o regeneración del LCA (factores de crecimiento, plasma rico en plaquetas –PRP–, células madre mesenquimales, andamiajes biológicos, etc.), habiéndose documentado múltiples ensayos in vitro, en animales de experimentación o estudios clínicos(27). Estos tratamientos biológicos conservan la inserción nativa de las fibras sanas y, consecuentemente, su función propioceptiva, lo que podría proporcionar una biomecánica más natural(27).
En un estudio clínico de lesiones parciales del LCA, Seijas et al.(28) presentan 19 casos de futbolistas con una rotura completa del fascículo AM y un fascículo PL íntegro, a los cuales se les aplican factores de crecimiento derivados de las plaquetas según la técnica descrita por Anitua (PRGF®-Endoret®)(29). Salvo un paciente, que presentaba lesiones condrales asociadas, todos se reincorporaron a la práctica deportiva a los 3-4 meses. En la RM de control al año se apreciaba ligamentización completa del fascículo en todos los casos.
Estas nuevas técnicas han mostrado resultados preclínicos y clínicos a corto plazo prometedores. Sin embargo, son necesarios estudios a largo plazo con un mayor número de pacientes y técnicas validadas para definir en un futuro próximo el papel de estos tratamientos biológicos en las lesiones parciales del LCA.
Tratamiento quirúrgico
El tratamiento con la reconstrucción selectiva-aumentación del fascículo lesionado puede estar justificado por diferentes factores(2). El primero es clínico: muchas roturas parciales del LCA progresan a roturas completas que incrementan la inestabilidad de la rodilla, con las posibles consecuencias potenciales sobre los meniscos y el cartílago. El segundo es biológico: los mecanorreceptores presentes en el remanente ligamentoso son responsables de preservar y restaurar la estabilidad de la rodilla(30). Estudios histológicos del remanente del LCA han demostrado su capacidad para acelerar la proliferación celular y la revascularización, y, por consiguiente, la integración del injerto en casos de reconstrucción selectiva(31). El tercer factor que apoya la reconstrucción de las lesiones parciales es el epidemiológico: el riesgo de lesiones degenerativas secundarias a roturas parciales del LCA ha sido descrito en hasta un 15% en un seguimiento a 8 años(32).
La reconstrucción selectiva del fascículo afectado sigue los principios básicos de la reconstrucción clásica anatómica del LCA (Figuras 9 y 10). Los autores realizan 3 portales: un portal anterolateral, lo más proximal posible con el fin de evitar la almohadilla grasa infrapatelar de Hoffa y tener una visión panorámica de toda la articulación; un portal AM alto y parapatelar, que utilizaremos como portal de visión y que nos va a permitir una mejor visualización de la huella anatómica femoral; y un portal AM accesorio, lateral al cóndilo femoral medial e inmediatamente superior al menisco interno, desde donde realizaremos el brocado del túnel femoral mediante técnica de manos libres(8). Otros autores recomiendan la realización del túnel femoral mediante técnica outside-in, considerando que ello facilita la realización del brocado femoral sin dañar las fibras del fascículo intacto(4).
figura10.png
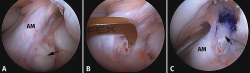
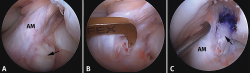
Figura 10. Plastia de reconstrucción selectiva unifascicular (fascículo posterolateral –PL–). A: imagen artroscópica de la rodilla izquierda desde el portal anterolateral. Se evidencia una rotura completa crónica del fascículo PL con remanente tibial (flecha) e integridad del fascículo anteromedial (AM); B: imagen artroscópica de la rodilla izquierda desde el portal anterolateral. Colocación de la guía tibial tomando el remanente como referencia en una reconstrucción selectiva del fascículo PL; C: imagen artroscópica desde el portal AM que muestra la plastia de reconstrucción selectiva-aumentación del fascículo PL con autoinjerto de isquiotibiales (flecha).
Técnicamente, en la reconstrucción selectiva del fascículo AM o PM es fundamental reproducir la huella anatómica, tanto en el fémur como en la tibia. La mejor referencia para conseguir una posición correcta es localizar el remanente del fascículo roto(33).
Diferentes tipos de injerto pueden ser seleccionados, tanto autoinjerto como haloinjerto, según la preferencia de cada cirujano. Los autores utilizan preferentemente los tendones de la pata de ganso (autoinjerto), habitualmente de 7-8 mm de diámetro. Calibres superiores pueden llenar en exceso el espacio intercondíleo y comprometer tanto el fascículo preservado como la extensión de la rodilla. Los injertos con taco óseo también pueden ser utilizados, pero se desaconseja su uso por la mayor dificultad a la hora de pasar los mismos a través de los túneles y la mayor probabilidad de destruir el remanente ligamentoso(2,19).
En cuanto a los dispositivos de fijación del injerto, los autores utilizan un sistema de fijación suspensoria ajustable en el fémur y un tornillo interferencial en la tibia, normalmente 1 mm superior al calibre del túnel brocado. Para la reconstrucción selectiva del fascículo PL, fijamos el mismo a 0° para minimizar el riesgo de rerrotura y, para el fascículo AM, lo fijamos a unos 20°, en ambos casos pretensionado y sumergido en una solución antibiótica con vancomicina para minimizar el riesgo de infección(34).
La rehabilitación en pacientes con una reconstrucción selectiva del LCA sigue los mismos criterios que los de una reconstrucción clásica por rotura completa del LCA(8,35). El retorno a la actividad deportiva se permite a partir de los 6 meses.
Recientemente, existe un renovado interés en las reparaciones primarias del LCA a pesar de que históricamente mostraron unos resultados pobres. Se trata de nuevas técnicas que asocian a la reparación tanto materiales sintéticos modernos como sistemas de aumentación para proteger el ligamento reparado y terapias biológicas que intentan favorecer la cicatrización ligamentosa. Las potenciales ventajas frente a las técnicas de reconstrucción son la preservación de la anatomía y la cinemática del LCA, y la propiocepción de la rodilla, reduciendo significativamente la morbilidad de la toma del injerto y la debilidad muscular secundaria(36,37,38,39,40). Diferentes autores publican resultados prometedores en estudios a 2-5 años con reincorporación deportiva al mismo nivel prelesional, que nos deben poner en alerta ante la introducción de este tipo de técnicas. De cualquier forma, son necesarios estudios a largo plazo, una selección adecuada del paciente y criterios de inclusión estrictos.
Conclusión
Actualmente, no existe consenso en la definición de las roturas parciales del LCA. El diagnóstico de este tipo de roturas se basa en la combinación de la historia del paciente, la exploración física, la RM y la evaluación artroscópica. A la hora de tomar una decisión en el tratamiento definitivo, el paciente debe ser evaluado en función de los síntomas funcionales y no sobre el daño estructural que presenta. La exploración bajo anestesia, en concreto la maniobra de pivot shift, sigue siendo el test más importante en la valoración funcional del LCA. El tratamiento quirúrgico definitivo debe basarse en la exploración artroscópica con valoración individual de la integridad de cada fascículo (AM y PL).
Basándose en el concepto de reconstrucción anatómica del LCA, la aumentación del fascículo lesionado se realiza preservando el fascículo intacto. Varios factores apoyan la preservación del remanente en lugar de su desbridamiento, incluyendo una mejor orientación del injerto, aumento de la estabilidad mecánica, vascularización y propiocepción, una ligamentización del injerto más rápida y, por último, una más rápida y segura rehabilitación del paciente. Recientemente, existe un renovado interés en las reparaciones del LCA mediante nuevas técnicas que asocian a la reparación tanto materiales sintéticos modernos, como sistemas de aumentación, que ayudan a proteger el ligamento reparado, asociados a terapias biológicas que favorecen la cicatrización ligamentosa.
Figuras
Figura 1. Anatomía normal del ligamento cruzado anterior (LCA). Esquemas sagital (A) y coronal (B) que ilustran la anatomía fascicular del LCA. AM: fascículo anteromedial; PL: fascículo posterolateral.
Figura 2. Anatomía normal del ligamento cruzado anterior (LCA) en secuencias convencionales de resonancia magnética (RM). A: corte sagital potenciado en densidad protónica (DP) con supresión grasa que muestra en toda su extensión el trayecto del fascículo anteromedial (AM); B: corte coronal de RM potenciado en DP con supresión grasa que muestra la anatomía bifascicular. PL: fascículo posterolateral.
Figura 3. Anatomía normal del ligamento cruzado anterior (LCA) en cortes oblicuos de resonancia magnética (RM). A: corte oblicuo coronal de RM potenciado en densidad protónica (DP) con supresión grasa adaptado al trayecto del LCA que muestra la anatomía bifascicular normal; B: corte oblicuo axial de RM potenciado en DP con supresión grasa perpendicular al trayecto del LCA que permite valorar el estado de ambos fascículos. AM: fascículo anteromedial; PL: fascículo posterolateral.
Figura 4. Rotura parcial del fascículo anteromedial (AM) del ligamento cruzado anterior (LCA) con formación de pequeño ganglión en la escotadura intercondílea. Corte oblicuo coronal (A) y axial (B) de resonancia magnética (RM) potenciados en densidad protónica con supresión grasa que muestran una rotura del fascículo AM (flechas). Fascículo posterolateral normal (cabezas de flecha).
Figura 5. Rotura parcial del fascículo posterolateral (PL) del ligamento cruzado anterior (LCA). Corte oblicuo coronal (A) y axial (B) de resonancia magnética (RM) potenciados en densidad protónica con supresión grasa que muestran una rotura completa proximal del fascículo PL (flechas). Fascículo anteromedial normal (cabezas de flecha).
Figura 6. Degeneración mucoide del ligamento cruzado anterior (LCA) . Imagen sagital de resonancia magnética (RM) potenciada en densidad protónica con supresión grasa que muestra engrosamiento y alteración de la señal difusos del ligamento cruzado anterior (flechas) y quistes en la inserción tibial (cabezas de flecha).
Figura 7. Rotura parcial del fascículo anteromedial (AM). A: esquema que ilustra una rotura parcial del ligamento cruzado anterior (LCA) afectando al fascículo AM; B: imagen artroscópica de la rodilla izquierda desde el portal anterolateral. Rotura completa del fascículo AM (flecha) con un fascículo posterolateral (PL) intacto y tenso a la exploración con el palpador.
Figura 8. Rotura parcial del fascículo posterolateral (PL). A: esquema que ilustra una rotura parcial del ligamento cruzado anterior (LCA) afectando al fascículo PL; B: visión artroscópica de la rodilla derecha desde el portal anterolateral. Se observa una rotura completa del fascículo PL (flecha), tras la separación con el palpador del fascículo anteromedial (AM).
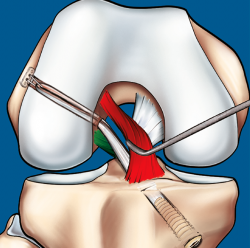
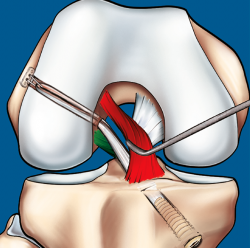
Figura 9. Esquema que ilustra el tratamiento con plastia de reconstrucción unifascicular posterolateral.
Figura 10. Plastia de reconstrucción selectiva unifascicular (fascículo posterolateral –PL–). A: imagen artroscópica de la rodilla izquierda desde el portal anterolateral. Se evidencia una rotura completa crónica del fascículo PL con remanente tibial (flecha) e integridad del fascículo anteromedial (AM); B: imagen artroscópica de la rodilla izquierda desde el portal anterolateral. Colocación de la guía tibial tomando el remanente como referencia en una reconstrucción selectiva del fascículo PL; C: imagen artroscópica desde el portal AM que muestra la plastia de reconstrucción selectiva-aumentación del fascículo PL con autoinjerto de isquiotibiales (flecha).
Información del artículo
Cita bibliográfica
Autores
Antonio Cruz Cámara
Hospital Santa Clotilde-Federación Cántabra de Fútbol. Santander
Clínica La Cañía. Santander
Alfredo Villalba Aramburu
Hospital Santa Clotilde-Federación Cántabra de Fútbol. Santander
Clínica La Cañía. Santander
Rebeca García Barcenilla
Servicio de Cirugía Ortopédica y Traumatología. Hospital Universitario Marqués de Valdecilla. Santander
Luis Cerezal Pesquera
Servicio de Radiología. Diagnóstico Médico Cantabria. Santander
Responsabilidades éticas
Conflicto de interés. Los autores declaran no tener ningún conflicto de intereses.
Financiación. Este trabajo no ha sido financiado.
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Referencias bibliográficas
-
1Naraghi A, White LM. MR imaging of cruciate ligaments. Magn Reson Imaging Clin N Am. 2014;22(4):557-80.
-
2Temponi EF, de Carvalho Júnior LH, Sonnery-Cottet B, Chambat P. Partial tearing of the anterior cruciate ligament: diagnosis and treatment. Rev Bras Ortop. 2015;50(1):9-15.
-
3Hantes ME, Tsarouhas A. Partial tear of the anterior cruciate ligament: management with one-bundle augmentation technique. En: Prodromos CC (ed.). The anterior cruciate ligament. Philadelphia: Elsevier; 2018. pp. 380-2.
-
4Sonnery-Cottet B, Colombet P. Partial tears of the anterior cruciate ligament. Orthop Traumatol Surg Res. 2016;102:S59-67.
-
5Petersen W, Zantop T. Partial rupture of the anterior cruciate ligament. Arthroscopy. 2006;22(11):1143-5.
-
6Ochi M, Dejour D, Nakamae A, Ntagiopoulos PG. Diagnosis of partial ACL rupture. En: Nakamura N, Zaffagnini S, Marx RG, Musahl V. Controversies in the technical aspects of ACL reconstruction. Springer; 2017. pp. 301-11.
-
7Sonnery-Cottet B, Chambat P. Arthroscopic identification of the anterior cruciate ligament posterolateral bundle: the figure-of-four position. Arthroscopy. 2007;23(10):1128.e1-3.
-
8Abat F, Gelber PE, Erquicia JI, Pelfort X, Tey M, Monllau JC. Promising short-term results following selective bundle reconstruction in partial anterior cruciate ligament tears. Knee. 2013;20(5):332-8.
-
9Van Dyck P, Vanhoenacker FM, Gielen JL, Dossche L, Van Gestel J, Wouters K, Parizel PM. Three tesla magnetic resonance imaging of the anterior cruciate ligament of the knee: can we differentiate complete from partial tears? Skeletal Radiol. 2011;40(6):701-7.
-
10Alaia EF, Benedick A, Obuchowski NA, Polster JM, Beltran LS, Schils J, et al. Comparison of a fast 5-min knee MRI protocol with a standard knee MRI protocol: a multi-institutional multi-reader study. Skeletal Radiol. 2018;47(1):107-16.
-
11Kijowski R, Davis KW, Woods MA, Lindstrom MJ, De Smet AA, Gold GE, Busse RF. Knee joint: comprehensive assessment with 3D isotropic resolution fast spin-echo MR imaging—diagnostic performance compared with that of conventional MR imaging at 3.0 T. Radiology. 2009;252(2):486-95.
-
12Gokalp G, Demirag B, Nas OF, Aydemir MF, Yazici Z. Contribution of thin slice (1 mm) oblique coronal proton density weighted MR images for assessment of anteromedial and posterolateral bundle damage in anterior cruciate ligament injuries. Eur J Radiol. 2012;81(9):2358-65.
-
13Lee JE, Park HJ, Lee SY, Ahn JH, Park JH, Park JY. Evaluation of Selective Bundle Injury to the Anterior Cruciate Ligament: T2-Weighted Fast Spin-Echo 3-T MRI With Reformatted 3D Oblique Isotropic (VISTA) Versus 2D Technique. AJR Am J Roentgenol. 2017;209(5):W308-16.
-
14Park HJ, Lee SY, Park NH, Ahn JH, Chung EC, Kim SJ, Cha JG. Three-dimensional isotropic T2-weighted fast spin-echo (VISTA) knee MRI at 3.0 T in the evaluation of the anterior cruciate ligament injury with additional views: comparison with two-dimensional fast spin-echo T2-weighted sequences. Acta Radiol. 2016;57(11):1372-9.
-
15Ng AW, Griffith JF, Hung EH, Law KY, Yung PS. MRI diagnosis of ACL bundle tears: value of oblique axial imaging. Skeletal Radiol. 2013;42(2):209-17.
-
16Van Dyck P, De Smet E, Veryser J, Lambrecht V, Gielen JL, Vanhoenacker FM, et al. Partial tear of the anterior cruciate ligament of the knee: injury patterns on MR imaging. Knee Surg Sports Traumatol Arthrosc 2012;20(2):256-61.
-
17Cavinatto L, Gupta S, Morgan C, Bartolozzi A. Value of preoperative MRI and examination under anesthesia for differentiating complete from partial anterior cruciate ligament tears. J Knee Surg. 2018:1-4.
-
18DeFranco MJ, Bach BR Jr. A comprehensive review of partial anterior cruciate ligament tears. J Bone Joint Surg Am. 2009;91(1):198-208.
-
19Colombet P, Dejour D, Panisset JC, Siebold R. Current concept of partial anterior cruciate ligament ruptures. Orthop Traumatol Surg Res. 2010;96(8 Suppl):S109-18.
-
20Paterno MV. Non-operative care of the patient with an ACL-deficient knee. Curr Rev Musculoskelet Med. 2017;10(3):322-7.
-
21Fitgerald GK, Axe MJ, Snyder-Mackler L. Proposed guidelines for nonoperative anterior cruciate ligament rehabilitation of physically active individuals. J Orthop Sports Phys Ther. 2000;30:194-203.
-
22Noyes FR, Mooar LA, Moorman CT 3rd, McGinniss GH. Partial tears of the anterior cruciate ligament. Progression to complete ligament deficiency. J Bone Joint Surg Br. 1989;71(5):825-33.
-
23Sommerlath K, Odensten M, Lysholm J. The late course of acute partial anterior cruciate ligament tears. A nine to 15-year follow-up evaluation. Clin Orthop Relat Res. 1992;(281):152-8.
-
24Tjoumakaris FP, Donegan DJ, Sekiya JK. Partial tears of the anterior cruciate ligament: diagnosis and treatment. Am J Orthop (Belle Mead NJ). 2011;40(2):92-7.
-
25Kocher MS, Micheli LJ, Zurakowski D, Luke A. Partial tears of the anterior cruciate ligament in children and adolescents. Am J Sports Med. 2002;30(5):697-703.
-
26Pujol N, Colombet P, Potel JF, Cucurulo T, Graveleau N, Hulet C, et al.; French Arthroscopy Society (SFA). Anterior cruciate ligament reconstruction in partial tear: Selective anteromedial bundle reconstruction conserving the posterolateral remnant versus single-bundle anatomic ACL reconstruction: preliminary 1-year results of a prospective randomized study. Orthop Traumatol Surg Res. 2012;98(8 Suppl):S171-7.
-
27Dallo I, Chahla J, Mitchell JJ, Pascual-Garrido C, Feagin JA, LaPrade RF. Biologic Approaches for the Treatment of Partial Tears of the Anterior Cruciate Ligament: A Current Concepts Review. Orthop J Sports Med. 2017;5(1):2325967116681724.
-
28Seijas R, Ares O, Cuscó X, Álvarez P, Steinbacher G, Cugat R. Partial anterior cruciate ligament tears treated with intraligamentary plasma rich in growth factors. World J Orthop. 2014;5(3):373-8.
-
29Anitua E. Plasma rich in growth factors: preliminary results of use in the preparation of future sites for implants. Int J Oral Maxillofac Implants. 1999;14(4):529-35.
-
30Nakase J, Toratani T, Kosaka M, Ohashi Y, Tsuchiya H. Roles of ACL remnants in knee stability. Knee Surg Sports Traumatol Arthrosc. 2013;21(9):2101-6.
-
31Siebold R, Fu FH. Assessment and augmentation of symptomatic anteromedial or posterolateral bundle tears of the anterior cruciate ligament. Arthroscopy. 2008;24(11):1289-98.
-
32Kannus P, Järvinen M. Conservatively treated tears of the anterior cruciate ligament. Long-term results. J Bone Joint Surg Am. 1987;69(7):1007-12.
-
33Chhabra A, Starman JS, Ferretti M, Vidal AF, Zantop T, Fu FH. Anatomic, radiographic, biomechanical, and kinematic evaluation of the anterior cruciate ligament and its two functional bundles. J Bone Joint Surg Am. 2006;88 (Suppl 4):2-10.
-
34Pérez-Prieto D, Torres-Claramunt R, Gelber PE, Shehata TMA, Pelfort X, Monllau JC. Autograft soaking in vancomycin reduces the risk of infection after anterior cruciate ligament reconstruction. Knee Surg Sports Traumatol Arthrosc. 2016;24(9):2724-8.
-
35Shaikh H, Rahnemai-Azar AA, Fu FH. Anterior cruciate ligament augmentation for one-bundle tears. Op Tech Orthop. 2017;27(1):43-51.
-
36Gipsman AM, Trasolini N, Hatch GFR 3rd. Primary anterior cruciate ligament single-bundle repair with augmentation for a partial anterior cruciate ligament tear. Arthrosc Tech. 2018;7(4):e367-72.
-
37Kuptniratsaikul S, Itthipanichpong T, Kuptniratsaikul V. Arthroscopic synthetic augmentation in acute partial injury of the anterior cruciate ligament. Arthrosc Tech. 2018;7(11):e1123-e1127.
-
38Gobbi A, Karnatzikos G, Sankineani SR, Petrera M. Biological augmentation of ACL refixation in partial lesions in a group of athletes: results at the 5-year follow-up. Tech Orthop. 2013;28(2):180-4.
-
39Gobbi A, Whyte GP. Long-term Outcomes of Primary Repair of the Anterior Cruciate Ligament Combined With Biologic Healing Augmentation to Treat Incomplete Tears. Am J Sports Med. 2018;46(14):3368-77.
-
40Murray MM, Kalish LA, Fleming BC; BEAR Trial Team, Flutie B, Freiberger C, et al. Bridge-Enhanced Anterior Cruciate Ligament Repair: Two-Year Results of a First-in-Human Study. Orthop J Sports Med. 2019;7(3):2325967118824356.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Puesta al día sobre el ligamento cruzado anterior: un nuevo número monográfico
- ¿Qué está de moda ahora en el ligamento cruzado anterior?
- Lesiones del ligamento cruzado anterior en pacientes esqueléticamente inmaduros
- Lesiones parciales del ligamento cruzado anterior
- Límites de la osteotomía en la ligamentoplastia de cruzado anterior
- Revisión del estado actual de las plastias empleadas en la reconstrucción ligamentosa en cirugía de rodilla
- Cirugía de revisión del ligamento cruzado anterior. ¿Uno o dos tiempos?
- Doble fascículo en el ligamento cruzado anterior. ¿Sigue indicado?
- Retorno al deporte tras la reconstrucción del ligamento cruzado anterior
- Refuerzos anterolaterales en la reconstrucción del ligamento cruzado anterior
- Reconstrucción del ligamento cruzado anterior con técnica de ahorro fisario intra-extraarticular con autoinjerto de cintilla iliotibial en pacientes esqueléticamente inmaduros
- Cirugía de revisión del ligamento cruzado anterior con injerto de tendón cuadricipital y tenodesis extraarticular lateral con fascia lata
- Rotura completa del fascículo posterolateral del ligamento cruzado anterior
- Neovasos hacia el fragmento luxado de una lesión en asa de cubo meniscal
- Reparación artroscópica de lesión meniscal con forma de asa de cubo
- Avulsión de su inserción en la rótula del ligamento patelofemoral medial
Más en Google Scholar


Revista Española de Artroscopia y Cirugía Articular está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.