Tendinopatía rotuliana: diagnóstico ecográfico y por resonancia magnética. Alternativas de tratamiento conservador y quirúrgico
Patellar tendinopathy: diagnosis by ultrasound and magnetic resonance imaging. Conservative and surgical management alternatives
Resumen:
Bajo el término tendinopatía rotuliana se engloban todas las lesiones que afectan el tendón rotuliano, en sus porciones proximal, central y distal. Además, se debe discriminar entre fases agudas (tendinitis), crónicas (tendinosis) o roturas de espesor completo.
La tendinopatía rotuliana es una lesión frecuente en aquellos deportistas que realizan actividades de salto o frenadas bruscas. A pesar de que afecta a un amplio número de pacientes (un 14% de la población general y hasta un 40% de los deportistas que realizan actividades de salto), su conocimiento sigue siendo escaso.
Una detallada exploración clínica juntamente con una evaluación ecográfica aportará información suficiente para saber qué lesión presenta el paciente. La resonancia magnética (RM) se utilizará para evaluar las posibles lesiones asociadas, sobre todo a nivel intraarticular.
El tratamiento debe ser inicialmente conservador y siempre acompañado de reducción de la carga y realización de ejercicios combinados excéntricos e isométricos. Cuando esta fase terapéutica inicial falla, se dispone de terapias mínimamente invasivas ecoguiadas que pueden promover el estado regenerativo. Cuando el tratamiento conservador falla, la cirugía debe ser minuciosa con la finalidad de incidir sobre la parte lesionada del tendón.
Abstract:
The term patellar tendinopathy encompasses all injuries of the patellar tendon in its proximal, central and distal portions. In addition, a distinction must be made between acute (tendinitis) and chronic phases (tendinosis) or full thickness ruptures.
Patellar tendinopathy is frequent in athletes involved in sports activities characterised by jumping or sudden stopping movements. Although many individuals are affected (14% of the general population and up to 40% of jumping athletes), knowledge of these injuries remains limited.
A detailed clinical exploration together with ultrasound assessment afford sufficient information to diagnose the injury. Magnetic resonance imaging (MRI) is used to evaluate possible associated lesions, particularly at intraarticular level.
Conservative management is initially indicated, always accompanied by reduction of weight bearing and the prescription of combined eccentric and isometric exercises. When this initial management phase fails, ultrasound-guided minimally invasive therapies are available that can facilitate regeneration. When conservative treatment proves ineffective, surgery must be careful in order to focus on the damaged part of the tendon.
Introducción
La tendinopatía rotuliana (TR) es un síndrome clínico caracterizado por dolor anterior de rodilla asociado con sensibilidad focal y lo más frecuente es que se ubique en el polo inferior de la rótula en la zona proximal del tendón rotuliano(1). La etiología principal de esta lesión son los movimientos repetitivos que causan una carga excesiva del tendón, particularmente durante los deportes que implican cambios rápidos de dirección, saltos y carreras, como voleibol, baloncesto o fútbol(2).
La incidencia de TR dentro de una temporada deportiva entre una población general de atletas se estimó en un 14,2%, con mayor incidencia en los deportes de salto y alcanzando un máximo de hasta un 44,6% en jugadores de voleibol(2). Afecta en mayor medida a los hombres con una proporción de 2:1,2. Una revisión sistemática detallada de los factores de riesgo de desarrollar TR mostró que los factores antropométricos, como un índice de masa corporal alto, circunferencia abdominal grande, discrepancia en la longitud de las extremidades o el arco del pie plano, aumentan la predisposición a padecer esta afección(3).
El diagnóstico se realiza mediante la anamnesis y el examen físico asociados a exámenes complementarios de imagen, entre los que destacan la ecografía y la resonancia magnética (RM). Se han descrito diferentes métodos para tratar la TR(4); sin embargo, no hay consenso sobre el mejor plan de tratamiento, porque a pesar de la gran cantidad de posibilidades terapéuticas no existen en la literatura actual estudios que brinden evidencia clínica sobre la superioridad de una alternativa terapéutica versus otra. Por lo tanto, el tratamiento ideal para la TR sigue sin estar claro(4,5).
El objetivo del presente trabajo es describir las diferentes opciones diagnósticas y proporcionar un análisis de los principales tratamientos conservadores y quirúrgicos actuales.
Fisiopatología
Se han propuesto varios modelos para explicar la fisiopatología de la TR. Uno de los modelos más actuales es el modelo continuo de Cook et al.(6), donde se plantea la hipótesis de que un tendón normal puede soportar la carga hasta que se supera el umbral individual de resistencia. Una vez superada la resistencia elástica del tendón, en primer lugar se presenta una tendinopatía reactiva, seguida de un deterioro tisular y una posterior degeneración fibrilar.
Scott et al.(7) describieron que, cuando los tendones están expuestos crónicamente a volúmenes de carga que sobrepasan la capacidad fisiológica, hay un ciclo de lesión y reparación acumulativo y, en función de la gestión de la carga, acaba en lesión o regeneración. Es decir, si se le da al tendón el tiempo adecuado para recuperarse, en buenas condiciones locales de flujo sanguíneo y nutrición, la maquinaria de curación prevalecerá con una regeneración completa. Sin embargo, si el tiempo de recuperación es demasiado corto y/o el flujo sanguíneo es inadecuado, la tensión repetitiva conducirá a la lesión definitiva del tendón.
Estudios bioquímicos respaldan la hipótesis de que, en el proceso inflamatorio, el intento de regeneración y posterior degeneración están entrelazados, ratificando la hipótesis de que la patogénesis de la tendinopatía es un continuo desde la fisiología hasta la presentación clínica manifiesta(8).
Utilizando técnicas de microdiálisis se ha observado que el estiramiento mecánico repetitivo aumenta la producción de prostaglandina E2 (PGE2) en los fibroblastos del tendón rotuliano humano. La PGE2 es un potente inhibidor de la síntesis de colágeno de tipo I y tiene efectos catabólicos sobre la estructura del tendón, disminuyendo la proliferación y la producción de colágeno(9). A su vez, como consecuencia de un aporte vascular insuficiente, se presenta un aumento del lactato. Este aumento de lactato y de la hipoxia tisular induce la producción del factor de crecimiento endotelial vascular (VEGF). Además de sus propiedades angiogénicas, el VEGF es capaz de regular la expresión de sustancias que promueven la degradación de la matriz extracelular, alterando así las propiedades mecánicas de los tendones. Esto podría predisponer al tendón a microdaños recurrentes y, a largo plazo, a la rotura espontánea. Fruto de la neoangiogénesis, los nervios generalmente acompañan a los neovasos dentro del tendón. Estos datos favorecen la hipótesis de que la neovascularización está asociada con la sintomatología clínica y, en particular, con el dolor(7,8,9).
En esta fase, el tendón muestra signos de degeneración y neovascularización en la evaluación por ultrasonido, aunque el paciente generalmente es asintomático. Se debe tener en cuenta que la tasa metabólica de los tendones es relativamente limitada y es más baja que la del músculo esquelético (el consumo de oxígeno es 7,5 veces menor y el tiempo de renovación del colágeno del tendón varía de 50 a 100 días)(10). Por lo tanto, la recuperación de los tendones después de una lesión lleva más tiempo en comparación con los músculos: mientras que para las lesiones musculares se requieren semanas, para las tendinopatías se requieren meses(3,4,6).
Diagnóstico
El diagnóstico de TR se debe centrar en una correcta anamnesis, la exploración clínica y las pruebas de imagen: ecografía musculoesquelética y RM.
Síntomas
El paciente presentará dolor bien localizado en el polo inferior de la rótula y la zona anterior de la rodilla. Es característico inicialmente el dolor insidioso desencadenado tras la actividad física que progresivamente se hace más persistente a medida que aumenta la frecuencia y la intensidad del ejercicio(11). En fases avanzadas puede incluso afectar actividades de la vida cotidiana, como bajar y subir escaleras, dolor ante periodos prolongados de sedestación, llegando incluso a afectar el descanso nocturno(12).
Exploración física
La atrofia e hipotonía del cuádriceps son hallazgos comunes ante una TR de larga evolución. Una repentina y rápida contracción del cuádriceps con la rodilla en extensión también puede provocar dolor(11).
reaca.29175.fs2002009-figura1.png
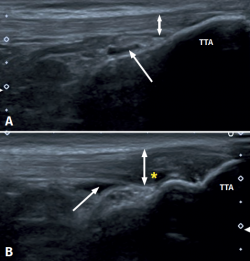
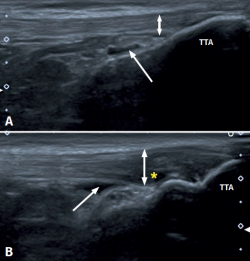
Figura 1. Imágenes ecográficas y sonda lineal del tendón rotuliano, porción distal. Visión longitudinal de las fibras del tendón en su inserción en la tuberosidad tibial anterior (TTA). A: inserción distal del tendón rotuliano normal. La flecha muestra una ligera bursitis, así como la doble flecha muestra el tamaño normal del tendón; B: tendinopatía rotuliana distal, donde se identifica la bursa infrapatelar profunda (flecha) con acúmulo de líquido en su interior (imagen hipoecoica), aumento del grosor del tendón (doble flecha) y un patrón fibrilar con disminución de la ecogenicidad (hipoecoica) por disrupción de las bandas de colágeno (asterisco).
La TR distal en el adulto (Figura 1) está asociada a una secuela de la enfermedad de Osgood-Schlatter. Esta osteocondritis de la tuberosidad tibial anterior se presenta en la edad prepuberal (varones: 12-15 años; mujeres: 8-13 años), es producida por la tracción del tendón sobre su inserción distal en la tuberosidad distal de la tibia y se caracteriza por un dolor a la palpación en la tuberosidad tibial anterior al examen físico(13). También está descrita su aparición a los 12-18 meses, antes de la finalización de la maduración del esqueleto(14).
Es importante destacar el diagnóstico diferencial del síndrome de dolor femoropatelar: aunque sean en la mayoría de las ocasiones fáciles de distinguir, hay situaciones en que pueden coexistir. Disponemos de pruebas funcionales muy útiles y se pueden realizar con o sin la ayuda de vendajes funcionales (McConnell). Una forma de reproducir el dolor a la exploración clínica sería mediante la realización de un squat test (Figura 2). Se realiza una sentadilla con flexión de 30° en apoyo monopodal sobre la pierna explorada, con la rodilla contralateral en extensión completa(15); será positivo para TR si el incremento de carga desencadena dolor, pudiéndose también valorar la fuerza muscular y la contracción cuadricipital y de isquiotibiales(4).
También se debe descartar la presencia de alteraciones intraarticulares en la rodilla (condropatías, meniscopatías y el síndrome de la almohadilla grasa o hoffitis) y el dolor referido de la cadera(16) mediante los estudios complementarios al examen físico.
Clasificación
El cuestionario de valoración funcional Victorian Institute of Sport Assessment-Patella (VISA-P) es una herramienta muy útil para valorar con medida el dolor y la función, permitiéndonos evaluar la gravedad de los síntomas y monitorizar los resultados(17,18).
En 1973, Blazina acuñó el término rodilla del saltador para describir la TR(19). Ideó un sistema de clasificación basado en las características clínicas que presentaban los pacientes afectos de tendinosis rotuliana. Actualmente, se utiliza la misma clasificación con alguna pequeña modificación. Dicho sistema incluye 4 grados (con un subgrado) según la severidad de los síntomas:
- Grado I: dolor durante la práctica deportiva.
- Grado II: dolor al comienzo de la actividad deportiva que desaparece después del calentamiento y reaparece con la fatiga muscular.
- Grado IIIa: dolor durante y después del ejercicio, que permite la práctica deportiva.
- Grado IIIb: dolor durante y después del ejercicio, que incapacita la práctica deportiva.
- Grado IV: rotura completa del tendón.
Se considera tendinopatía aguda cuando el tiempo de evolución oscila entre 1 y 6 semanas, subaguda entre 6 y 12 semanas, y crónica cuando supera los 3 meses de evolución.
Diagnóstico por ecografía
La ecografía musculoesquelética es una herramienta muy útil para la exploración de la patología tendinosa. Con la llegada de los modernos aparatos de ecografía de alta resolución, pasó a ser esencial en el estudio de estas lesiones(12,20). La ecografía es un método no invasivo, económico, rápido y dinámico que permite obtener mucha información sobre el tendón a tratar. Se utiliza tanto como método diagnóstico, como para guiar las terapias invasivas. Se debe tener en cuenta que es dependiente del técnico, con lo que la curva de aprendizaje es de vital importancia para poder afinar su uso(20,21,22). Estudios como el de Wardeb et al. mostraron las ventajas de la ecografía con estudio Doppler-color (DC) frente a la RM(20).
reaca.29175.fs2002009-figura3.png
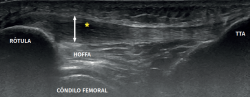
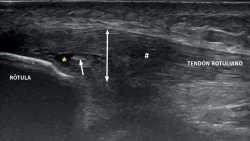
Figura 3. Imagen ecográfica de tendinopatía rotuliana proximal con sonda lineal en visión panorámica longitudinal craneocaudal (de izquierda a derecha). Obsérvese el área de disminución de la ecogenicidad (hipoecoica) marcada con un asterisco, la pérdida del patrón fibrilar en la región más profunda y proximal del tendón por disrupción de las bandas de colágeno, así como un engrosamiento de 8,5 mm anteroposterior (doble flecha). TTA: tuberosidad tibial anterior.
El estudio ecográfico de un tendón lesionado mostrará imágenes con hipoecogenicidad y pérdida del patrón fibrilar, aparición de tejido conectivo desorganizado y engrosamiento del tendón (Figura 3). En ocasiones, encontraremos imágenes hipoecoicas bien delimitadas, indicativas de roturas intrasustancia de formas nodulares o fibrilares, de presentación habitual en la región más profunda del tendón en el polo inferior contiguo a la rótula (Figura 4).
En la porción media del tendón se puede observar engrosamiento (> 3,5 mm), asociado a áreas hipoecoicas con zonas de desorganización del colágeno y perdida del patrón fibrilar.
También es frecuente visualizar irregularidades corticales en la entesis proximal del tendón en su unión con la rótula, afección del paratendón con adherencias a la de grasa de Hoffa. Si existen calcificaciones, estas se mostrarán como zonas blancas hiperecogénicas (Figura 5).
El estudio con DC es una ventaja adicional en el estudio de tendinopatías, ya que nos permite visualizar el flujo sanguíneo dentro del tendón. Dado que un tendón sano es prácticamente avascular, la presencia de vasos sanguíneos dentro del mismo nos describirá un proceso patológico(20,23).
reaca.29175.fs2002009-figura6.png
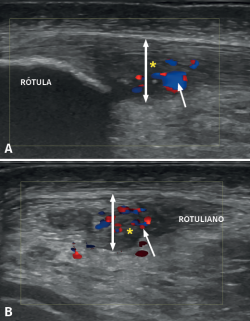
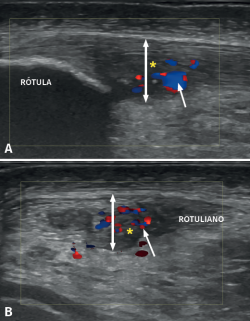
Figura 6. Ecografía Doppler en un paciente con tendinosis rotuliana. La imagen A muestra un corte longitudinal, mientras que la imagen B muestra un corte transversal. La doble flecha señala el aumento del grosor del tendón y el asterisco las zonas hipoecogénicas correspondientes a las áreas de lesión fibrilar. La flecha muestra las hipervascularizaciones de predominio en la zona profunda y central.
La aparición de actividad vascular intratendinosa (Figura 6), detectada por DC o Doppler-Power (DP), interpretada como neovascularización, ha sido descrita en diversos estudios como parte de un proceso de reparación o fallo del mismo(24).
Diagnóstico por resonancia magnética
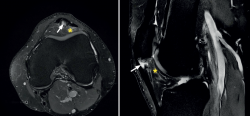
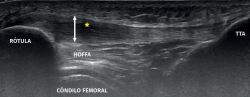
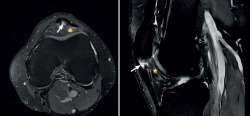
El hallazgo más común en la RM es el aumento de señal en el polo inferior patelar con imagen de ensanchamiento local en la región afectada del tendón (Figura 7)(14,25). La ventaja más evidente de esta técnica sobre la ecografía es su capacidad de visualizar lesiones asociadas en la articulación y su cartílago, así como también la presencia de edema óseo y afectación de la grasa de Hoffa (Figura 7). Como clara desventaja, cabe destacar su coste elevado y la no posibilidad de realizarla en movimiento ni en diferentes ángulos de flexión de la rodilla.
Tratamiento
El tratamiento más adecuado para la TR dependerá de la gravedad de los síntomas, así como del tiempo de evolución de estos. Inicialmente se debe intentar un tratamiento conservador y, en caso de que este resulte insuficiente, se optará por el tratamiento quirúrgico(4,5,25,26,27).
Tratamiento conservador
El tratamiento conservador incluye las terapias no invasivas como la medicación con analgésicos, antiinflamatorios y la rehabilitación con fisioterapia (principalmente los ejercicios excéntricos explicados más adelante), además de las terapias percutáneas invasivas(4,28).
Los analgésicos y principalmente los antiinflamatorios no esteroideos tienen poca eficacia en el tratamiento de la TR. Más aún cuando estamos tratando generalmente fases avanzadas de la lesión, por lo que no hay un proceso inflamatorio activo. Las infiltraciones con corticoides (a pesar de ser ampliamente utilizadas) han demostrado tener más riesgos que ventajas. Su principal riesgo es promover el deterioro del tejido tendinoso, pudiendo causar así roturas o calcificaciones, además de alterar la síntesis de colágeno(28).
Existen diferentes programas de rehabilitación con fisioterapia descritos en la literatura(29,30). Actualmente, el ejercicio excéntrico se ha posicionado como la principal terapia conservadora para tratar la TR(4). Los programas de ejercicios excéntricos más utilizados tienen una duración de 12 semanas e incluyen 1 o 2 sesiones de carga diaria, produciendo un efecto de mejoría en cuanto al dolor y disminuyendo la neovascularización del tendón(29,30). Debe ser supervisado por personal cualificado que determine el rango de trabajo, las cargas y el modo de ejecución(31). La correcta realización de un programa de trabajo excéntrico(29,31) conjugado con pautas de estiramientos y ejercicios isométricos analgésicos(32) proporcionan muy buenos resultados cuando se combinan con otras terapias conservadoras.
Dentro de las terapias percutáneas invasivas destaca la electrólisis ecoguiada, conocida como ultrasound guided galvanic electrolysis technique (USGET), que es una técnica mínimamente invasiva que consiste en la aplicación en el tejido dañado de una corriente galvánica bajo unos parámetros específicos. Produce una reacción electroquímica no termal que desencadena un proceso inflamatorio y posteriormente regenerativo en el tejido dañado(5,33,34,35). El proceso proinflamatorio y regenerativo producido por la USGET debe ser complementado con ejercicio excéntrico para estimular la fase proliferativa y de remodelación que conducirá en muchos casos a la curación de la lesión tendinosa(5). Los resultados de la electrólisis ecoguiada o USGET han sido descritos en la literatura tanto a largo plazo de seguimiento para verificar así su seguridad(34), como en ensayos clínicos controlados(35).
Las inyecciones de alto volumen guiadas por imagen (high volume image guided injections –HVIGI–) se dirigen al crecimiento neurovascular (desde el paratendón hacia el tendón). Las HVIGI son inyecciones guiadas por ultrasonido donde se utiliza un alto volumen en la interfaz entre el tendón rotuliano y el cuerpo de Hoffa (consiste en 10 mL de bupivacaína al 0,5%, 25 mg de hidrocortisona y entre 12 y 40 mL de solución normosalina), producen efectos mecánicos locales, rompiendo u ocluyendo los neovasos y el suministro nervioso que los acompañan, y se utilizan principalmente en TR en las cuales el tratamiento conservador es insuficiente y se evidencia presencia de neovasos en la ecografía Doppler(36).
En los casos en los que se desee dar un aporte con la terapia biológica con plasma rico en plaquetas (PRP) se debe tener presente la falta de protocolos terapéuticos(4). Existe un gran debate en la literatura actual por la existencia de resultados controvertidos entre los diferentes estudios, se difiere sobre el número de infiltraciones, así como la mejor concentración de plaquetas y leucocitos para cada caso(37,38,39). En el consenso de tendinopatías realizado por la European Society of Sports Traumatology, Knee Surgery and Arthroscopy (ESSKA), el PRP se plantea como opción terapéutica válida para tratar la TR. Se recomienda su utilización de forma ecoguiada intratendinosa, algunos estudios refieren resultados mejores con 2 dosis que una sola, existe mejor respuesta en tendinopatía aguda que en crónica, no se recomienda utilizar conjuntamente anestésicos locales porque producen un efecto perjudicial sobre la agregación plaquetaria y, por último, presenta mejores resultados su aplicación cuando se realiza conjuntamente con protocolos de rehabilitación con buena adherencia(5). El futuro del PRP en la TR está abierto, se requieren más estudios con protocolos clínicos estandarizados específicos para la preparación de PRP para lesiones agudas y crónicas.
Otros tratamientos conservadores como las células progenitoras, la terapia génica o el empleo de biomateriales se están planteando como opciones futuras que precisan de mayor estudio y comprensión(5).
Tratamiento quirúrgico
Cuando a pesar de realizar el tratamiento conservador el paciente presenta persistencia del dolor con impotencia funcional que limita la actividad deportiva, se considera que el tratamiento conservador ha fallado y debemos abogar por un tratamiento más invasivo. A pesar de que actualmente no existe ningún estudio comparativo definitorio sobre qué técnica quirúrgica es mejor utilizar, la tendencia actual aboga por el uso de la artroscopia combinada con ecografía (sonocirugía), descrita por Alfredson et al.(5,25,36,40,41,42). Se realiza un desbridamiento de la parte más profunda y deteriorada del tendón, donde se forman adherencias del paratendón y la grasa de Hoffa (desbridamiento artroscópico), permitiendo controlar mejor la profundidad y orientando mejor la triangulación(25).
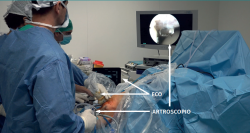
Con el paciente en decúbito supino se realiza un recorrido artroscópico para analizar las posibles lesiones asociadas a la TR. El cirujano debe tener visión directa sobre el aparato de ecografía y la torre de artroscopia (Figura 8). Se utilizarán 2 portales, uno anterolateral y otro anteromedial, ligeramente más inferiores a los que utilizaríamos para realizar una meniscectomía. Se procederá con un desbridamiento controlado con ecografía de la grasa de Hoffa adyacente al paratendón. Es recomendable no usar torniquete, ya que eso permitirá evidenciar con la ecografía dónde están las hipervascularizaciones y se podrán eliminar las mismas con el sinoviotomo. En el caso de tener roturas intrasustancia, se deberá realizar un desbridamiento minucioso de las mismas, así como remover el posible osteofito distal en la rótula.
reaca.29175.fs2002009-figura8.png
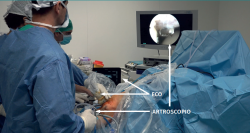
Figura 8. Montaje del campo quirúrgico en una sonocirugía por tendinosis rotuliana. Obsérvese cómo el cirujano debe tener visión directa de la pantalla del artroscopio, así como la del ecógrafo simultáneamente. El ayudante controla la visión ecográfica, mientras que el cirujano principal maniobra con el artroscopio y el instrumental.
Existen otras técnicas quirúrgicas como el peinado del tendón, la resección osteotendinosa abierta, la resección tendinosa artroscópica, la resección-reparación tendinosa abierta o la electrocoagulación ecoguiada(27,41,42). Actualmente, el consenso europeo sugiere el uso de la sonocirugía para tratar las tendinopatías rotulianas recalcitrantes(5).
Conclusiones
La TR sigue siendo un reto para el traumatólogo deportivo. La correcta clasificación y el uso de la ecografía para el diagnóstico, el tratamiento y el seguimiento son de vital importancia. En los casos refractarios al tratamiento conservador, la opción quirúrgica con sonocirugía ofrece buenos resultados.
Figuras
Figura 1. Imágenes ecográficas y sonda lineal del tendón rotuliano, porción distal. Visión longitudinal de las fibras del tendón en su inserción en la tuberosidad tibial anterior (TTA). A: inserción distal del tendón rotuliano normal. La flecha muestra una ligera bursitis, así como la doble flecha muestra el tamaño normal del tendón; B: tendinopatía rotuliana distal, donde se identifica la bursa infrapatelar profunda (flecha) con acúmulo de líquido en su interior (imagen hipoecoica), aumento del grosor del tendón (doble flecha) y un patrón fibrilar con disminución de la ecogenicidad (hipoecoica) por disrupción de las bandas de colágeno (asterisco).
Figura 2. Realización de exploración física mediante squat test en plano declinado para la evaluación del dolor. Se realiza una sentadilla monopodal con flexión de 30º de la rodilla afecta y con la rodilla contralateral en extensión.
Figura 3. Imagen ecográfica de tendinopatía rotuliana proximal con sonda lineal en visión panorámica longitudinal craneocaudal (de izquierda a derecha). Obsérvese el área de disminución de la ecogenicidad (hipoecoica) marcada con un asterisco, la pérdida del patrón fibrilar en la región más profunda y proximal del tendón por disrupción de las bandas de colágeno, así como un engrosamiento de 8,5 mm anteroposterior (doble flecha). TTA: tuberosidad tibial anterior.
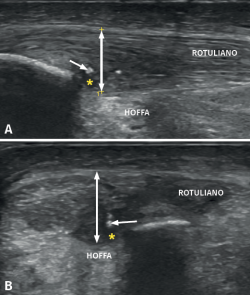
Figura 4. Tendinopatía rotuliana estudiada con ecografía de alta definición. Sonda lineal en visión longitudinal. La doble flecha muestra un tendón engrosado con zonas de alteración del patrón fibrilar hipoecogénicas (#), rotura intrasustancia (asterisco), así como fibrosis (flecha).
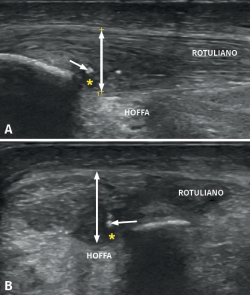
Figura 5. Visión ecográfica con sonda lineal de alta definición en corte longitudinal (A) y transversal (B). La doble flecha muestra un tendón engrosado con zonas de lesión intrasustancia (asterisco), así como calcificaciones (flecha).
Figura 6. Ecografía Doppler en un paciente con tendinosis rotuliana. La imagen A muestra un corte longitudinal, mientras que la imagen B muestra un corte transversal. La doble flecha señala el aumento del grosor del tendón y el asterisco las zonas hipoecogénicas correspondientes a las áreas de lesión fibrilar. La flecha muestra las hipervascularizaciones de predominio en la zona profunda y central.
Figura 7. Imagen por resonancia magnética donde se observa una alteración del tendón rotuliano proximal con engrosamiento y edema (flecha blanca), en un segmento de 1,5 cm de longitud. Notable edema de la grasa de Hoffa adyacente (asterisco).
Figura 8. Montaje del campo quirúrgico en una sonocirugía por tendinosis rotuliana. Obsérvese cómo el cirujano debe tener visión directa de la pantalla del artroscopio, así como la del ecógrafo simultáneamente. El ayudante controla la visión ecográfica, mientras que el cirujano principal maniobra con el artroscopio y el instrumental.
Información del artículo
Cita bibliográfica
Autores
Ferrán Abat González
Traumatólogo deportivo, ReSport Clinic Barcelona.
Universidad Blanquerna, Ramon Llull. Barcelona
Servicio de Cirugía Ortopédica y Traumatología. Hospital de la Santa Creu i Sant Pau. Universitat Autònoma de Barcelona
Adrián Martín Martínez
Servicio de Cirugía Ortopédica y Traumatología. Hospital Universitario Miguel Servet. Zaragoza
Ignacio de Rus Aznar
Servicio de Cirugía Ortopédica y Traumatología. Clinica CEMTRO. Madrid
Unidad de Hombro y Codo. Hospital Universitario Ramón y Cajal. Madrid
Servicio de Cirugía Ortopédica y Traumatología. Hospital Monográfico Asepeyo Coslada. Madrid
Hospital Universitario de Torrejón. Madrid
Jocelio Campos Moraes
ReSport Clinic Barcelona. Universidad Blanquerna, Ramon Llull. Barcelona
Gustabo Sosa
ReSport Clinic Barcelona. Universidad Blanquerna, Ramon Llull. Barcelona
Unidad de Medicina Deportiva. Hospital Universitario Quirón Dexeus. Barcelona
Bruno Capurro
ReSport Clinic Barcelona. Universidad Blanquerna, Ramon Llull. Barcelona
Responsabilidades éticas
Conflicto de interés. Los autores declaran no tener ningún conflicto de interés.
Financiación. Este trabajo no ha sido financiado.
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Referencias bibliográficas
-
1Maffulli N, Giai Via A, Oliva F. Revision Surgery for Failed Patellar Tendinopathy Exploration. Sports Med Arthrosc Rev. 2017 Mar;25(1):36-40.
-
2Lian OB, Engebretsen L, Bahr R. Prevalence of jumper’s knee among elite athletes from different sports: a crosssectional study. Am J Sports Med. 2005;33:561-7.
-
3Van Der Worp H, Van Ark M, Roerink S, Pepping GJ, Van Den Akker-Scheek I, Zwerver J. Risk factors for patellar tendinopathy: a systematic review of the literature. Br J Sports Med. 2011;45(5):446-52.
-
4Abat F, Alfredson H, Cucchiarini M, Madry H, Marmotti A, Mouton C, et al. Current trends in tendinopathy: consensus of the ESSKA basic science committee. Part I: biology, biomechanics, anatomy and an exercise-based approach. J Exp Orthop. 2017 Dec;4(1):18.
-
5Abat F, Alfredson H, Cucchiarini M, et al. Current trends in tendinopathy: consensus of the ESSKA basic science committee. Part II: treatment options. J Exp Orthop. 2018 Sep 24;5(1):38.
-
6Cook JL, Purdam CR. Is tendon pathology a continuum? A pathology model to explain the clinical presentation of load-induced tendinopathy. Br J Sports Med. 2009 Jun;43(6):409-16.
-
7Scott A, Backman LJ, Speed C. Tendinopathy: Update on Pathophysiology. J Orthop Sports Phys Ther. 2015 Nov;45(11):833-41.
-
8Abate M, Silbernagel KG, Siljeholm C, et al. Pathogenesis of tendinopathies: inflammation or degeneration? Arthritis Res Ther. 2009;11(3):235.
-
9Cilli F, Khan M, Fu F, Wang JH. Prostaglandin E2 affects proliferation and collagen synthesis by human patellar tendon fibroblasts. Clin J Sport Med. 2004;14:232-6.
-
10Kjaer M, Langberg H, Magnusson P. Overuse injuries in tendon tissue: insight into adaptation mechanisms. Ugeskr Laeger. 2003;165:1438-43.
-
11Khan KM, Cook JL, Kannus P, Maffulli N, Bonar SF. Time to abandon the “tendinitis” myth. BMJ. 2002;324(7338):626-7.
-
12Cook JL, Khan KM, Kiss ZS, et al. Patellar tendinopathy in junior basketball players: a controlled clinical and ultrasonographic study of 268 patellar tendons in players aged 14-18 years. Scand J Med Sci Sports. 2000;10:216-20.
-
13Gholve PA, Scher DM, Khakharia S, Widmann RF, Green DW. Osgood Schlatter syndrome. Curr Opin Pediatr. 2007;19(1):44-50.
-
14Circi E, Atalay Y, Beyzadeoglu T. Treatment of Osgood-Schlatter disease: review of the literature. Musculoskelet Surg. 2017 Dec;101(3):195-200.
-
15Figueroa D, Figueroa F, Calvo R. Patellar Tendinopathy: Diagnosis and Treatment. J Am Acad Orthop Surg. 2016 Dec;24(12):e184-e192.
-
16Lam S, Amies V. Hip arthritis presenting as knee pain. BMJ Case Rep. 2015;2015:bcr2014208625.
-
17Visentini PJ, Khan KM, Cook JL, Kiss ZS, Harcourt PR, Wark JD. The VISA score: an index of severity of symptoms in patients with jumper’s knee (patellar tendinosis). Victorian Institute of Sport Tendon Study Group. J Sci Med Sport. 1998;1:22-8.
-
18Abat González F, Capurro B, de Rus Aznar I, Martín Martínez A, Campos Moraes J, Sosa G. Tendinopatía rotuliana: enfoque diagnóstico y escalas de valoración funcional. Rev Esp Artrosc Cir Articul. 2021;28(3).
-
19Blazina ME, Kerlan RK, Jobe FW, Carter VS, Carlson GJ. Jumper’s knee. Orthop Clin North Am. 1973;4:665-78.
-
20Warden SJ, Kiss ZS, Malara FA, Ooi AB, Cook JL, Crossley KM. Comparative accuracy of magnetic resonance imaging and ultrasonography in confirming clinically diagnosed patellar tendinopathy. Am J Sports Med. 2007 Mar;35(3):427-36.
-
21Fazekas ML, Sugimoto D, Cianci A, Minor JL, Corrado GD, d'Hemecourt PA. Ultrasound examination and patellar tendinopathy scores in asymptomatic college jumpers. Phys Sportsmed. 2018 Nov;46(4):477-84.
-
22McAuliffe S, McCreesh K, Culloty F, Purtill H, O'Sullivan K. Can ultrasound imaging predict the development of Achilles and patellar tendinopathy? A systematic review and meta-analysis. Br J Sports Med. 2016 Dec;50(24):1516-23.
-
23Malliaras P, Purdam C, Maffulli N, et al. Temporal sequence of greyscale ultrasound changes and their relationship with neovascularity and pain in the patellar tendon. Br J Sports Med. 2010;44:944–7.
-
24Cook JL, Khan KM, Kiss ZS, et al. Asymptomatic hypoechoic regions on patellar tendon ultrasound: a 4-year clinical and ultrasound followup of 46 tendons. Scan J Med Sci Sports. 2001;11:321-7.
-
25Golman M, Wright ML, Wong TT, et al. Rethinking Patellar Tendinopathy and Partial Patellar Tendon Tears: A Novel Classification System. Am J Sports Med. 2020;48(2):359-69.
-
26Fernandez-Jaén T, Sanz-Zapata F, Cortés JM, et al. Proposal for a Clinical Analysis of Patellar Tendon Pathologies: In Search of Efficient Therapeutic Indications. Orthop J Sports Med. 2020 Aug 31;8(8):2325967120946312.
-
27Chen PC, Wu KT, Chou WY, et al. Comparative Effectiveness of Different Nonsurgical Treatments for Patellar Tendinopathy: A Systematic Review and Network Meta-analysis. Arthroscopy. 2019 Nov;35(11):3117-31.e2.
-
28Dean BJ, Lostis E, Oakley T, Rombach I, Morrey ME, Carr AJ. The risks and benefits of glucocorticoid treatment for tendinopathy: a systematic review of the effects of local glucocorticoid on tendon. Semin Arthritis Rheum. 2014 Feb;43(4):570-6.
-
29Rio E, van Ark M, Docking S, et al. Isometric Contractions Are More Analgesic Than Isotonic Contractions for Patellar Tendon Pain: An In-Season Randomized Clinical Trial. Clin J Sport Med. 2017 May;27(3):253-9.
-
30Dos Santos Franco YR, Miyamoto GC, Franco KFM, de Oliveira RR, Cabral CMN. Exercise therapy in the treatment of tendinopathies of the lower limbs: a protocol of a systematic review. Syst Rev. 2019 Jun 15;8(1):142.
-
31Cook JL, Stasinopoulos D, Brismée JM. Insertional and mid-substance Achilles tendinopathies: eccentric training is not for everyone - updated evidence of non-surgical management. J Man Manip Ther. 2018 Jul;26(3):119-22.
-
32Malliaras P, Barton CJ, Reeves ND, Langberg H. Achilles and patellar tendinopathy loading programmes : a systematic review comparing clinical outcomes and identifying potential mechanisms for effectiveness. Sports Med. 2013 Apr;43(4):267-86.
-
33Abat F, Valles SL, Gelber PE, et al. Molecular repair mechanisms using the Intratissue Percutaneous Electrolysis technique in patellar tendonitis. Rev Esp Cir Ortop Traumatol. 2014 Jul-Aug;58(4):201-5.
-
34Abat F, Gelber PE, Polidori F, Monllau JC, Sánchez-Ibáñez JM. Clinical results after ultrasound-guided intratissue percutaneous electrolysis and eccentric exercise in the treatment of patellar tendinopathy. Knee Surg Sports Traumatol Arthrosc. 2015 Apr;23(4):1046-52.
-
35Abat F, Sánchez-Sánchez JL, Martín-Nogueras AM, et al. Randomized controlled trial comparing the effectiveness of the ultrasound-guided galvanic electrolysis technique (USGET) versus conventional electro-physiotherapeutic treatment on patellar tendinopathy. J Exp Orthop. 2016 Dec;3(1):34.
-
36Crisp T, Khan F, Padhiar N, et al. High volume ultrasound guided injections at the interface between the patellar tendon and Hoffa’s body are effective in chronic patellar tendinopathy: a pilot study. Disabil Rehabil. 2008;30:1625-34.
-
37Filardo G, Di Matteo B, Kon E, Merli G, Marcacci M. Platelet-rich plasma in tendon-related disorders: results and indications. Knee Surg Sports Traumatol Arthrosc. 2018 Jul;26(7):1984-99.
-
38Kaux JF, Croisier JL, Forthomme B, et al. Using platelet-rich plasma to treat jumper's knees: Exploring the effect of a second closely-timed infiltration. J Sci Med Sport. 2016 Mar;19(3):200-4.
-
39Scott A, LaPrade RF, Harmon KG, et al. Platelet-Rich Plasma for Patellar Tendinopathy: A Randomized Controlled Trial of Leukocyte-Rich PRP or Leukocyte-Poor PRP Versus Saline. Am J Sports Med. 2019 Jun;47(7):1654-61.
-
40Willberg L, Sunding K, Ohberg L, Forssblad M, Alfredson H. Treatment of Jumper's knee: promising short-term results in a pilot study using a new arthroscopic approach based on imaging findings. Knee Surg Sports Traumatol Arthrosc. 2007 May;15(5):676-81.
-
41Villardi AM, Villardi JGCC, de Paula RE, Carminatti T, Serra Cruz R. Surgical Technique for Chronic Proximal Patellar Tendinopathy (Jumper's Knee). Arthrosc Tech. 2019 Nov 13;8(11):e1389-e1394.
-
42Moura JL, Abreu FG, Queirós CM, et al. Ultrasound-Guided Electrocoagulation of Neovessels for Chronic Patellar Tendinopathy. Arthrosc Tech. 2020 May 14;9(6):e803-e807.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- La lesión de tendón, del eterno olvidado a una patología de moda
- Fisiología y mecanobiología del tejido tendinoso y muscular
- Tendinopatía rotuliana: diagnóstico ecográfico y por resonancia magnética. Alternativas de tratamiento conservador y quirúrgico
- Fisiopatología, diagnóstico y tratamiento de la tendinopatía aquílea
- Tendinopatía del supraespinoso: diagnóstico ecográfico y por resonancia magnética. Alternativas de tratamiento conservador y quirúrgico
- Resultados de reparación artroscópica de tendón glúteo medio en pacientes afectos de síndrome de dolor trocantérico. Serie de casos
- Actualización en el diagnóstico y el tratamiento de las lesiones musculares del cuádriceps
- Manejo de las lesiones musculares del tríceps sural en deportistas adultos jóvenes y de mediana edad: revisión narrativa de la literatura
- Tendinopatía insercional del tendón de Aquiles. Tratamiento de principio a fin
- Cíclope invertido
Más en PUBMED
Más en Google Scholar


Revista Española de Artroscopia y Cirugía Articular está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.