Fracaso de la reconstrucción del ligamento cruzado anterior. Revisión de la literatura
Anterior cruciate ligament reconstruction failure. Review of the literature
Resumen:
La cirugía reconstructiva del ligamento cruzado anterior (LCA) mediante técnicas artroscópicas ha experimentado un rápido crecimiento en las últimas décadas, constituyendo un significativo porcentaje del total de las intervenciones ortopédicas. La tendencia actual promueve el uso de abordajes poco invasivos, con la máxima preservación anatómica, ambulatorios en muchas ocasiones y, consecuentemente, con una más rápida rehabilitación. Todo ello supone un aumento en la expectativa de recuperación por parte del paciente que demanda resultados. Sin embargo, la cirugía de reconstrucción del LCA, como cualquier otra técnica quirúrgica, no está exenta de resultados insatisfactorios. Proponemos una revisión bibliográfica sobre los diferentes parámetros a valorar en el concepto de “fracaso de la cirugía de reconstrucción del LCA” y añadimos comentarios bibliográficos y técnicos para su manejo y resolución.
Abstract:
The anterior cruciate ligament reconstruction (ACLR) through arthroscopic techniques has experienced rapid growth in recent decades, constituting a significant percentage of the total orthopedic surgeries. The current trend promotes the use of non-invasive approaches, with the maximum anatomic preservation, ambulatory in many occasions and consequently, with a faster rehabilitation. All this implies an increase in the expectation of patient’s recovery who demands faster and better results. However, ACLR, like any other surgical technique, is not exempt from unsatisfactory results. We propose a bibliographic review of the different parameters to be assessed in the concept of “ACLR failure”, and we add bibliographical and technical comments for its management and resolution.
Introducción
Una revisión hoy (mayo de 2020) en PubMed sobre el tema “anterior cruciate ligament surgery” nos arroja un total de 16.853 artículos (5.562 en los últimos 4 años: 2016-2020). Si acotamos la búsqueda al tema que nos ocupa (“failed anterior cruciate ligament surgery”), encontramos un total de 512 artículos (129 entre 2016 y 2020). En un momento en donde la presión por el resultado final se ejerce desde muy diferentes ámbitos, la industria ofrece nuevos y más modernos dispositivos y en el que no existe ni tiempo ni artículos de calidad para comparar de forma crítica los resultados, creemos necesario hacer una pausa. Un momento para reflexionar acerca de lo que tantos han publicado con anterioridad, los factores más implicados en el fracaso de la cirugía del ligamento cruzado anterior (LCA), añadiendo algunos de los artículos más relevantes a criterio de los autores. Esta revisión pretende ser de ayuda para todos aquellos cirujanos con un volumen reducido de cirugías del LCA por año.
“Debería considerarse fallo clínico toda rodilla intervenida por rotura del LCA que presente una inestabilidad recurrente o que, aun siendo estable, presente dolor o rigidez, con un rango de movimiento entre 10 y 120°”(1). Inestabilidad, dolor y rigidez han sido clásicamente los parámetros que han definido el “fracaso de la cirugía de reconstrucción del LCA”. Pero, a pesar del intento de Fu(1), no existe consenso unánime ni sobre esta definición ni de su contenido.
A las complicaciones generales de los procedimientos quirúrgicos en la rodilla –como son: hemartrosis, hematoma, infección, tromboflebitis/trombosis venosa profunda, complicaciones cutáneas, lesión vasculonerviosa, parálisis por el torniquete y distrofia simpático refleja– se añaden otras de carácter más específico relacionadas con la reconstrucción del LCA o la obtención de su injerto(2,3,4,5,6).
Si la tasa de buenos resultados de la reconstrucción del LCA recogida en la literatura es del 75-90%, ¿deberíamos considerar un 10-25% de fracasos? Muchos aspectos influyen sobre la respuesta anatómica y biomecánica de la reconstrucción del LCA.
Etiología multifactorial
Centrar la definición de fracaso en la cirugía de reconstrucción del LCA en los parámetros clásicos de estabilidad, rigidez y dolor puede llevarnos a subestimar la verdadera magnitud de una realidad mucho mayor.
Entre las causas más frecuentes que pueden conducir a un resultado poco satisfactorio están los errores técnicos (colocación de los túneles no anatómica, mala selección del injerto o una fijación insuficiente del mismo), nuevos traumatismos en el postoperatorio, fallos biológicos (fallo en la incorporación del injerto), la infección, la artrofibrosis, una rehabilitación por exceso o por defecto, la laxitud prequirúrgica, el estado previo de los cartílagos articulares y meniscos, la omisión en el diagnóstico y el tratamiento de otras lesiones que supongan una alteración de los elementos estabilizadores secundarios de la rodilla y una inestabilidad combinada, o la motivación y expectativas del paciente(2,5,6,7) (Tabla 1). Aunque no hay consenso sobre los porcentajes y probablemente el fracaso se deba a la combinación de varios factores, la deficiente técnica quirúrgica parece ser la más frecuentemente citada en la literatura, en hasta un 70% de los casos(7,8).
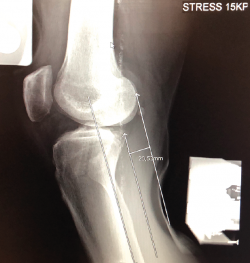
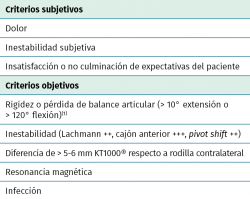
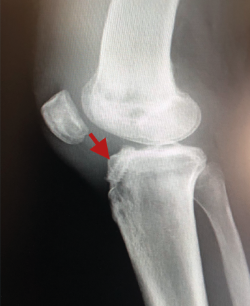
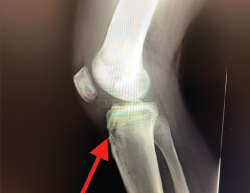
Desde el punto de vista clínico, se consideran motivo de revisión quirúrgica aquellos casos en los que exista un desplazamiento anterior comparado con el contralateral mayor de 5 mm, pivot shift de alto grado, dolor, inflamación, sensación subjetiva de inestabilidad y limitación funcional para las actividades de la vida diaria o deportiva(9,10). Algunos autores han rebajado esta cifra a 3 mm con respecto a la rodilla contralateral o 10 mm de desplazamiento absoluto en el plano sagital(11) (Figura 1).
Indicaciones y contraindicaciones
El tratamiento de un paciente que sufre una rotura aguda del LCA (Figura 2) sigue siendo motivo de discusión(9). Hay muchos condicionantes que influyen en el manejo terapéutico de estas lesiones (ya sea quirúrgico como no quirúrgico), como son la edad, la ocupación, la actividad deportiva, las lesiones asociadas, el grado de laxitud de la rodilla, las expectativas o las recidivas de la lesión, entre otras. El riesgo de artrosis tras la rotura aguda del LCA será mayor en ambos grupos con respecto a la población sana, sea cual sea el tratamiento(12). Los factores de riesgo más importantes para el desarrollo de artropatía son: lesión meniscal, meniscectomía e injerto hueso-tendón-hueso (HTH).
La indicación para la reconstrucción quirúrgica de un LCA en un paciente joven con una deficiencia crónica y sintomática es más clara que la de tratar una rotura aguda del LCA en un paciente relativamente poco activo(12). Aunque la cirugía diferida ha presentado resultados excelentes, la demora quirúrgica en pacientes jóvenes con inestabilidad sintomática tiene mayor riesgo de lesión condral y/o meniscal a los 6 meses de la lesión.
Planificación preoperatoria
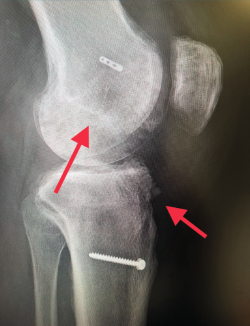
Un diagnóstico y una planificación correctos son fundamentales. En caso de rotura de plastia del LCA (Figura 3), se hace obligatoria, además de una detallada exploración, un correcto estudio radiológico completo que incluya radiología convencional y resonancia magnética (RM) –estudio de lesiones acompañantes o degeneración previa–. En ocasiones en donde la anamnesis/exploración lo justifique, pueden ser también necesarias telemetrías de extremidades inferiores, radiología forzadas (si existiera inestabilidad mediolateral) o tomografía axial computarizada (TAC) –valoración de la posición y la calidad de los túneles–.
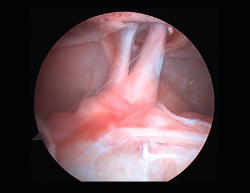
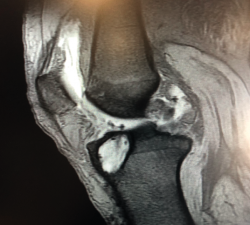
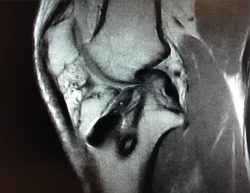
La literatura ha identificado diferentes grupos de riesgo altamente expuestos a un fracaso de la cirugía del LCA. Pacientes hiperlaxos, mujeres jóvenes o con una alta demanda funcional (deportes de pivotaje) tienen cifras mayores de fracaso(10,12). El estudio detallado de estos casos, así como la identificación de posibles factores agravantes –pendiente tibial(13), eje mecánico varo-valgo, escotadura intercondílea estrecha(14) (Figura 4)–, pueden hacer necesario añadir gestos quirúrgicos correctores, como son la osteotomía tibial, el remodelado de la escotadura intercondílea o una plastia extraarticular de refuerzo (Figura 5).
Se considera que una pendiente tibial > 13° genera una sobrecarga mecánica de la plastia en extensión(13). Existen en el mercado placas específicas de osteotomía proximal de la tibia especialmente diseñadas para evitar conflicto entre el túnel tibial y los tornillos de dicha placa.
Cada vez aparecen más artículos que apoyan la idea de añadir plastias extraarticulares(15) en cirugías primarias del LCA en estas poblaciones de alto riesgo (hiperlaxos, menores de 25 años, que practiquen deportes de pivotaje a alto nivel) y en cirugía de revisión del LCA. Faltan, sin embargo, estudios que comparen las diferentes técnicas disponibles entre sí (tenodesis anterolateral vs. plastia anterolateral) y que ofrezcan resultados clínicos a más largo plazo (Figura 6).
Complicaciones
Nos centraremos en aquellas complicaciones que conciernen específicamente a la rodilla y a la cirugía del LCA (Tablas 2 y 3).
Inestabilidad o laxitud persistente
La laxitud persistente después del tratamiento quirúrgico de una lesión del LCA se valorará en forma de cajón anterior. Las causas de esta inestabilidad anterior son: ausencia de corrección de dicha inestabilidad, plastia con resistencia mecánica insuficiente, colocación incorrecta de la plastia, tensado incorrecto del injerto, mala fijación de la plastia o inadecuada rehabilitación inicial(16).
Crawford et al.(17), tras una revisión sistemática de 14 ensayos clínicos, reportaron los resultados de rotura del injerto y fracaso clínico a los 10 años de la reconstrucción del LCA. La tasa de rotura del injerto a los 10 años fue del 6,2% y la de fracaso de la reconstrucción del LCA del 10,3%. Este estudio define como inestabilidad diferentes parámetros, como son puntuaciones C y D en el IKDC (International Knee Documentation Committee) Score, inestabilidad a la exploración en maniobras de Lachman o pivot shift, y traslación anterior medida con KT-1000® de al menos 5 mm comparada con la extremidad sana.
En este apartado podemos diferenciar 2 subtipos de inestabilidad: traumática o atraumática(9).
Inestabilidad recurrente traumática
Las plastias de LCA pueden sufrir rerroturas secundarias a traumatismos agudos o a mecanismos de repetición(9). Asimismo, las rerroturas agudas pueden estar originadas por un accidente casual sobre una plastia funcionante correctamente colocada o sobre una plastia insuficiente, mecánicamente débil. Las rerroturas por fatiga, en cambio, suelen ser consecuencia de defectos técnicos(9).
La verdadera incidencia de rerrotura traumática es discutida, entre el 5 y el 43% según las publicaciones(5,17,18,19). La rehabilitación intensiva excesivamente precoz y el aumento de la actividad en el postoperatorio aumentan el riesgo de lesionar un injerto insuficientemente maduro(20). Cargas excesivas durante la fase inicial de integración de la plastia pueden producir deformidades plásticas de la misma y su consecuente elongación e insuficiencia mecánica.
Inestabilidad recurrente atraumática
La inestabilidad recurrente atraumática o plastia insuficiente es la causa más frecuente de fracaso de la cirugía de reconstrucción del LCA, siendo la causa más habitual los errores técnicos(9).
Los errores técnicos más frecuentes son: la incorrecta colocación de los túneles (70%) –especialmente una colocación demasiado anterior del túnel femoral–, una inadecuada trocleoplastia, mala fijación del injerto, tensión inadecuada de la plastia o un infradiagnóstico de lesiones asociadas.
Rigidez
Una de las complicaciones más temidas, producida por un aumento del tejido fibroso, ya sea por la propia lesión (primaria) o secundaria a diferentes motivos (error técnico en la cirugía, síndrome del cíclope, inmovilización prolongada o la participación insuficiente en un programa de rehabilitación, infección, síndrome del dolor regional complejo, hematomas o sinovitis) (Figuras 7 y 8). Esta puede variar desde una ligera limitación del rango de movilidad hasta una severa artrofibrosis(21).
Las principales causas secundarias a errores técnicos son la malposición de la plastia y el tensado excesivo. La radiografía permite ver la localización de los túneles e implantes, así como la RM visualiza las partes blandas implicadas, pudiendo identificar posibles pinzamientos de la plastia –escotadura intercondílea, síndrome del cíclope (Figura 9), síndrome de la contractura infrapatelar(22) (Figura 10)–.
Para reducir el riesgo de artrofibrosis, los esfuerzos deben ir encaminados a tratar aquellas circunstancias específicas que puedan demorar la cirugía, a enfatizar una buena pauta de rehabilitación inicial previa a la intervención así como la posterior a la intervención, teniendo como objetivo una recuperación del rango completo de movilidad entre las 6 y las 8 semanas tras la cirugía(8,23,24).
Las limitaciones pueden ser tanto en flexión como en extensión, siendo las segundas mucho más limitantes funcionalmente. Mientras la disminución de la flexión suele ser fácil de recuperar mediante artrolisis artroscópica y manipulación bajo sedación, una disminución de 5 y 10° de extensión puede desembocar en una incapacidad importante con cojera de la marcha.
El factor más importante implicado en la aparición de artrofibrosis es el tiempo transcurrido entre el accidente y la cirugía. Rodillas multioperadas pueden ser más susceptibles de artrofibrosis. Hay que tener en cuenta que la rigidez no es una complicación exclusiva del tratamiento quirúrgico. También puede aparecer en pacientes que opten por el tratamiento ortopédico conservador no quirúrgico, tras periodos prolongados de inmovilización. En pacientes con poca demanda funcional, en los que se opta por el tratamiento no quirúrgico, debería prestarse especial atención en evitar inmovilizaciones prolongadas(12).
La cronología tras la cirugía es también importante. Durante los 3 primeros meses tras la intervención podemos tratar satisfactoriamente rigideces menores con rehabilitación, antiinflamatorios no esteroideos (AINE) y manipulación. Más allá de los 4 meses, se recomienda desbridamiento artroscópico. No se recomienda la manipulación bajo anestesia sin una liberación articular artroscópica del tejido cicatricial. El desbridamiento artroscópico incluye la retirada de tejido cicatricial, grasa de Hoffa, liberación cuadricipital de la cara anterior femoral y de los recesos laterales, y ocasionalmente liberación de retináculos patelares si la movilidad patelar fuera insuficiente(23).
Dolor persistente
Aunque rara vez puede ser causa aislada de revisión quirúrgica de la plastia, a este grupo pertenecen aquellas situaciones con dolor persistente en relación con la intervención que pueden provocar la sensación de mal resultado por parte del paciente.
El dolor en cara anterior de la rodilla –entre el 3 y el 47% según las series(12)– depende especialmente del tipo de injerto obtenido y del protocolo de rehabilitación postoperatorio(2,3,4,56,7,8), aunque existen más factores a tener en cuenta, como son la existencia de dolor anterior previo, lesiones de la articulación femoropatelar, contractura en flexión/flexo, debilidad cuadricipital y una rehabilitación agresiva con sobrecarga del tendón rotuliano.
Otra causa poco frecuente de dolor en la cara anterointerna es la neuralgia del nervio safeno o, más concretamente, de la rama infrapatelar del nervio safeno. Se han descrito diferentes abordajes tibiales para la obtención del injerto minimizando la eventual lesión neurológica (vertical vs. oblicuo), pero lo cierto es que la gran variabilidad anatómica de esta rama hace del todo imprevisible su afectación.
Deficiente protocolo de rehabilitación
Una inapropiada recuperación funcional postoperatoria puede afectar negativamente a los resultados de la reconstrucción del LCA(25), tanto por exceso como por defecto. La recidiva del cajón anterior se puede producir con ejercicios que eleven las fuerzas en un injerto insuficientemente maduro(19,24) (por ejemplo, ejercicios de hiperextensión no controlados), así como una más que evitable rigidez.
De la revisión sistemática de metaanálisis de Anderson et al.(12) se desprenden varias conclusiones. Existe una sustancial evidencia en la literatura sobre históricas controversias alrededor de la rehabilitación:
- No parece haber ningún beneficio acerca de la inmovilización con ortesis tras la intervención o el uso de dispositivos CPM (continuous passive motion).
- La rehabilitación precoz dirigida y los ejercicios de cadena cinética abierta parecen ser beneficiosos.
- Tanto el entrenamiento propioceptivo como el de resistencia previos a la cirugía pueden ser beneficiosos.
De ahí que pacientes con una innecesaria inmovilización (en lesión aislada del LCA) o demora en el inicio de tratamiento rehabilitador conlleven peores resultados finales. Aunque un tratamiento rehabilitador excesivo, demasiado intensivo/precoz y el aumento de la actividad en el postoperatorio pueden también aumentar el riesgo de lesión de la nueva plastia. Un protocolo de rehabilitación apropiado y progresivo se hace imprescindible para el buen resultado final.
Otras
Los derrames de repetición suponen un problema en las primeras semanas tras la cirugía y pueden interferir en el proceso de rehabilitación. El tratamiento de estos derrames debe incluir la artrocentesis (cuando sea necesario), AINE, crioterapia y reposo funcional. Un derrame persistente a los 2 meses de la intervención es indicativo de que existe un problema intraarticular aún sin resolver(9).
Por último, también están la insatisfacción, la falta de culminación de las expectativas o factores psicológicos. A todas las causas de fracaso ya comentadas, podríamos añadir otra un tanto más subjetiva como es la insatisfacción. A este grupo, aunque menos frecuente, pertenecerían aquellos pacientes que, aun habiendo presentado un buen curso postoperatorio y en ausencia de las complicaciones anteriormente comentadas, no presentan puntuaciones de satisfacción altas al no haber conseguido cubrir las expectativas generadas.
Los factores psicológicos son importantísimos. Se ha observado una fuerte relación entre la puntuación obtenida en escalas de tipo psicológico como la Anterior Cruciate Ligament Return to Sport After Injury (ACL-RSI) y una nueva lesión del LCA. Una puntuación inferior a 77 puntos tiene una sensibilidad del 90% y una especificidad de 47% en pacientes jóvenes para una nueva lesión del LCA. El 90% de los pacientes con una nueva lesión del LCA obtuvieron una puntuación inferior al corte de 77 puntos(25).
Es obligatoria una conversación pausada médico-paciente, especialmente en pacientes deportistas o de alta demanda física. Aunque la gran mayoría de los pacientes intervenidos volverán a practicar deporte, solo el 65% de los pacientes que practican deporte a un nivel recreativo volverán al mismo nivel que tenían previo a la lesión. En un reciente estudio del Swedish Knee Ligament Registry en pacientes futbolistas seguidos durante 10 años, tan solo el 51% volvió a jugar al fútbol. Las causas más frecuentes para no volver a la práctica del fútbol fueron relacionadas con la rodilla en un 63% (dolor/inestabilidad en un 50% y miedo a una nueva lesión en un 32%). Aquellos que volvieron a jugar tuvieron un riesgo mayor de nueva lesión en comparación con el jugador sano. Se registraron un 9,7% por fallo de la plastia y un 20,6% por rotura contralateral, con un 28,7% global de rerroturas del LCA(26).
Factores técnicos
Los fallos técnicos más habituales están en relación con un injerto resistente, una correcta colocación de los túneles femoral y tibial, un tensado correcto de la plastia y una fijación firme del injerto, entre otros.
Injerto
El tipo de injerto utilizado ha sido y es aún motivo de controversia. Existe evidencia de que el injerto HTH de tendón rotuliano muestra mayor estabilidad que el injerto isquiotibial. A pesar de esta estabilidad teórica, los resultados en escalas de valoración funcional y la tasa de fallo no difieren entre ambas plastias(12).
Revisiones sistemáticas en estudios prospectivos aleatorizados comparando la plastia de isquiotibiales con las de HTH han sugerido que el tipo de injerto no es el principal determinante del éxito de la reconstrucción del LCA(27). La mayoría de los fallos se deben a otros errores técnicos y no a la elección del injerto(9). Aunque el HTH sigue siendo el gold standard, la plastia cuádruple (o triple) de isquiotibiales gana en popularidad y reaparecen tendencias como son el tendón cuadricipital, el aloinjerto o la aumentación híbrida de la plastia con sistemas sintéticos. Estudios biomecánicos de laboratorio confieren mayor resistencia a las plastias cuádruples frente a las triples. Las triples con refuerzo sintético consiguen unos resultados similares a las plastias cuádruples de isquiotibiales(28).
La bibliografía, lejos de decantar la balanza de las ventajas e inconvenientes de cada técnica, ofrece, a nuestro parecer, un aumento del abanico técnico de posibilidades a considerar por el cirujano, debiendo ser cada caso evaluado individualmente(12).
Deberemos tener en cuenta el tipo de actividad física habitual del paciente, los antecedentes de lesiones femoropatelares, las cirugías previas, el grosor de la plastia y la técnica habitual del cirujano. No debemos tampoco olvidar las características biológicas de cada injerto.
El proceso de integración de la plastia conocido como ligamentización consta de 3 fases: fase inicial de cicatrización, fase de proliferación y fase de maduración(29,30). Sin embargo, no existe consenso sobre la cronología de estas fases. Parece que las plastias de isquiotibiales y, especialmente los aloinjertos, tienen unos “tiempos” de ligamentización más lentos que las de HTH(12,29,30).
Túnel femoral
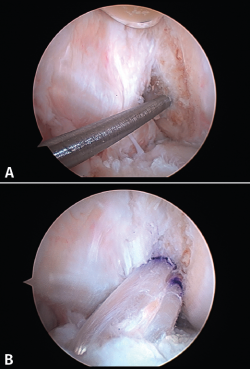
La posición del túnel femoral ha sido la que más cambios ha experimentado en las últimas décadas. Las primeras plastias con técnica monotúnel (con un túnel femoral prácticamente vertical) ofrecían muy buena estabilidad anteroposterior, pero con escaso control de la estabilidad rotacional y frecuentemente con un pivot shift test positivo en el postoperatorio. Las nuevas técnicas tienden a horizontalizar la plastia a través de un portal accesorio anteromedial (Figuras 11A y 11B), dando así mayor estabilidad dual, tanto anteroposterior como rotacional. Este gesto técnico, con la rodilla en posición artroscópica de flexión, puede provocar un túnel femoral excesivamente anterior, con la consecuente pérdida de función estabilizadora de la plastia. Es muy importante hallar la huella anatómica del LCA original. El cambio de portal artroscópico para su correcta visualización es un gesto técnico sencillo y de utilidad (Figura 12).
El punto idóneo para su colocación en el plano sagital es tan posterior como sea posible, respetando el límite posterior de la pared medial del cóndilo femoral externo, dejando al menos 2 mm de pared, y en la zona horaria de las 22 h o las 14 h en el plano coronal(9) (Figura 13). Un injerto demasiado anterior en el fémur dará lugar a un ligamento tensionado y elongado en flexión, provocando un déficit de flexión. Por el contrario, un túnel femoral muy posterior provocará una excesiva tensión de la plastia; esta puede romperse o generar contracturas en flexo con déficit de extensión en los últimos grados(9). Los flexos de rodilla provocan graves alteraciones de la marcha y son causa de dolor anterior de rodilla por sobrecarga femoropatelar.
Túnel tibial
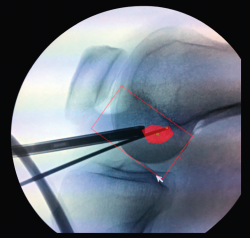
Aunque el punto de entrada extraarticular pueda variar, la salida del túnel tibial a nivel intraarticular es fija. Idealmente, esta será sobre el muñón residual del LCA, centrado sobre la espina tibial interna, paralelo al borde posterior del cuerno anterior del menisco externo y 7 mm anterior al ligamento cruzado posterior (LCP) (Figura 14). Jugando con el ángulo de la guía tibial podremos variar la longitud del túnel. El objetivo es permitir que las fibras de la plastia se dispongan de forma inclinada y paralelas a la línea de Blumensaat en extensión (Figura 15).
Suponiendo que la colocación de los túneles sea correcta, se tensará la plastia entre 0 y 20° de flexión. Esta posición permitirá conseguir la alineación sagital tibial sin restringir la amplitud de movimientos en extensión. Si el injerto de LCA se tensara en mayor flexión, se debe comprobar la extensión completa de la rodilla meticulosamente para asegurar que la amplitud de movimientos es completa.
Un túnel tibial muy anterior producirá una sobretensión de la plastia en los últimos grados de extensión por pinzamiento con el techo de la escotadura o por un déficit en los últimos grados en forma de flexo de rodilla (Figura 16). Por el contrario, un túnel tibial muy posterior provocará una excesiva laxitud en flexión(9).
En rodillas con un recurvatum (será necesario explorar ambas rodillas previamente) puede ser interesante retrasar ligeramente a posterior la emergencia intraarticular del túnel tibial con la intención de minimizar el posible pinzamiento de la plastia en hiperextensión, o bien realizar un remodelado de la escotadura intercondílea. Asimismo, en las insuficiencias crónicas del LCA se observa con más frecuencia este cierre o estrechamiento de la escotadura intercondílea que puede comprometer nuestra plastia en extensión –en forma de catedral gótica (Figura 4)–. En estos casos, es necesario realizar una condiloplastia para aumentar el espacio intercondíleo –en forma de catedral románica (Figura 5)–.
Fijación del injerto
La fijación firme del injerto es de vital importancia para el éxito de la reconstrucción del LCA. Existen varios métodos de fijación (tornillos interferenciales, sistemas de suspensión cortical o fijaciones híbridas con una combinación de estos). Se ha escrito mucho acerca de la tensión de la plastia teóricamente ideal, pero lo cierto es que su aplicabilidad intraoperatoria es limitada. Se podría resumir en una tensión suficiente que permita la reducción del cajón anterior y que permita una correcta movilidad de la rodilla.
Existen 2 riesgos con el tornillo interferencial tibial. En primer lugar, el tornillo puede empujar la plastia dentro del túnel, produciendo una pérdida de tensión (se aconseja mantener la plastia en tensión durante el atornillado y prestar especial atención a la imagen artroscópica). En segundo lugar, la poca resistencia del hueso medular de la tibia proximal puede provocar una fijación interferencial inadecuada (la experiencia y el chasquido característico al encontrar aumento de resistencia serán garantía de correcta fijación)(9).
Una vez fijado el injerto, comprobamos el rango de movilidad total de la rodilla. Los sistemas de fijación cortical permiten retensar el injerto en caso de laxitud residual. Debemos realizar este gesto técnico con precaución, puesto que un retensado excesivo con una rodilla en flexión (posición artroscópica clásica) puede conllevar un compromiso de la extensión.
La tendencia actual de la industria hacia técnicas all-inside, con doble sistema de dispositivos de suspensión cortical, está dando buenos resultados iniciales. Se precisan más estudios con un seguimiento más amplio para conocer sus resultados a más largo plazo.
Isometría
En cuanto a la isometría (entendida como estado de longitud constante), la teoría dice que la plastia debería mantenerse uniforme durante todo el arco de movilidad de la rodilla, pudiendo elongarse menos de 3 mm(31,32). La realidad es que una estructura tan compleja como el LCA, bifascicular para unos(3,5), acintada para otros(33) (Figuras 17 y 18), es del todo imposible imitar su comportamiento a la perfección con una plastia más bien cilíndrica, por lo que el concepto de isometría debería ir ligado más al de posicionamiento anatómico de la plastia imitando al máximo posible el comportamiento del ligamento nativo. El concepto teórico de isometría, ampliamente estudiado in vitro(34,35), representa un objetivo idealista per se in vivo.
Fallo biológico en la incorporación del injerto
Ya hemos hablado del proceso de ligamentización de la plastia. El tiempo estimado para la maduración del injerto oscila entre los 9 y los 48 meses(36,37,38). Se calcula que la resistencia del injerto antes de haber llegado a la fase de maduración puede ser entre un 30 y un 50% menor(39).
Ahora bien, existe un fenómeno de expansión/dilatación de los túneles óseos que perjudica a la correcta fijación de la plastia (Figura 19). Esta dilatación puede incluso conllevar a la aparición de fístulas de líquido sinovial. Esta situación conocida como “efecto parabrisas” ocurre cuando el túnel no se ajusta perfectamente a la plastia y se da mayor frecuencia con el uso de plastias de isquiotibiales, el uso de aloinjertos e implantes sintéticos. Se recomienda usar tornillos interferenciales que bloqueen la plastia lo más cerca posible de su salida a la articulación para evitar este efecto(40).
Infradiagnóstico de lesiones asociadas
Un alto porcentaje de las lesiones del LCA presentan lesiones concomitantes. El infradiagnóstico de estas lesiones asociadas perjudicará ineludiblemente al resultado final. Es el caso de un 15% de los fracasos en la reconstrucción del LCA(41). Una anamnesis minuciosa con una exploración física rigurosa, estudios con radiografías y RM, una exploración bajo anestesia y una artroscopia diagnóstica previa a la ligamentoplastia son la mejor manera de evitar errores en la valoración de las lesiones asociadas(42).
Debemos realizar estudios radiográficos de rutina para descartar fracturas, evaluar cambios degenerativos preexistentes y comprobar la alineación de la extremidad inferior. La RM es especialmente útil para mostrar roturas meniscales, contusiones óseas, lesiones condrales y otras lesiones ligamentosas.
El ligamento lateral interno (LLI), el ligamento lateral externo (LLE), el ángulo posteroexterno (APE), el LCP, la cápsula posterior o meniscectomías amplias, especialmente del cuerno posterior del menisco interno, pueden alterar la cinemática de la rodilla y, por tanto, aumentar las solicitaciones sobre el LCA(43,44). Valk et al.(45) demostraron que los pacientes con lesión meniscal tenían peores resultados a los 2 a 6 años tras la reconstrucción del LCA.
Infecciones
Diversas revisiones han reportado una incidencia de artritis séptica tras la reconstrucción del LCA del 0,5 al 0,6%(46,47,48). El tratamiento de elección es el desbridamiento artroscópico con abundante irrigación y con antibioterapia específica.
Según Anderson et al.(12), la media de desbridamientos es de 1,52-1,92 por infección. Se aconsejan también en estos casos revisiones en 2 tiempos para garantizar la ausencia de infección(46,47,48).
Hemartrosis, artrofibrosis y pérdida de la movilidad articular
Tanto la rotura traumática del LCA como su cirugía de reconstrucción pueden provocar una hemartrosis en la rodilla, con el consecuente riesgo de artrofribrosis y pérdida de movilidad articular(12). Es preferible retrasar inicialmente la cirugía hasta que la movilidad de la rodilla mejore y se encuentre prácticamente recuperada (frecuentemente entre 2 y 3 semanas)(49). Esperar a que esta respuesta inflamatoria aguda haya cedido se ha asociado con una menor dificultad para recuperar el rango de movilidad previo. Asimismo, deberemos controlar el hemartros postoperatorio (se han descrito lesiones de la arteria geniculada externa como causa de hemartros de repetición). Aunque no existen diferencias clínicamente significativas publicadas en la bibliografía sobre resultados a largo plazo, el uso de drenajes aspirativos las primeras 24 h, un correcto control de la hemostasia quirúrgica, crioterapia y tratamiento rehabilitador progresivo son gestos que colaboran a un menor hemartros. Excepcionalmente, puede ser necesaria una revisión quirúrgica para una correcta hemostasia.
La artrofibrosis posquirúrgica derivada del hemartros e iniciada desde la cascada química que este provoca es una entidad algo más insidiosa en su aparición. Un mal control analgésico postoperatorio puede favorecer una incorrecta recuperación funcional inicial, provocando así la limitación del balance articular de la rodilla.
El correcto equilibrio entre analgesia y rehabilitación funcional son determinantes para evitar la progresión de la artrofibrosis.
Otras
Existen otros factores, tanto intrínsecos como extrínsecos, implicados en la rotura del LCA.
Entre los numerosos factores de riesgo intrínsecos identificados en el fracaso de la reconstrucción del LCA se encuentran: la geometría del LCA en las mujeres, un pie pronador, la inclinación pélvica o pelvic tilt, la hiperlaxitud generalizada, la laxitud anterior de rodilla en las mujeres, la fase del ciclo menstrual, un valgo dinámico, la preactivación flexora/extensora en las mujeres, la predisposición familiar, la presencia del gen colágeno de tipo I alpha (COL1A1), la altura o el índice de masa corporal(50,51,52).
Prodromos et al.(53), tras un metaanálisis de 25 estudios epidemiológicos, encontraron un riesgo de rerrotura del LCA 3 veces mayor en mujeres jóvenes que realizaban deportes de pivotaje (fútbol y baloncesto) en comparación con varones jóvenes.
Dos revisiones sistemáticas han examinado los riesgos extrínsecos de rotura del LCA(54,55). Se han identificado como riesgo aquellas superficies que generan un aumento de la fricción zapatilla-suelo y que predisponen al deportista a maniobras imprevistas. Estas revisiones encontraron mayor riesgo de lesión del LCA en superficies sintéticas en jugadores de fútbol americano, aunque no se dieron los mismos resultados en jugadores de fútbol (europeo).
En resumen, existen diversos factores intrínsecos y extrínsecos que aumentan el riesgo de rotura del LCA, aunque los 2 factores intrínsecos más importantes son un aumento de la inclinación tibial (slope) y un estrechamiento de la escotadura intercondílea.
Rerrotura
El riesgo de rerrotura es conocidamente mayor en pacientes jóvenes (menores de 25 años), hiperlaxos y del sexo femenino (OR: 1,7)(56). Recientemente, el MOON Group(51), al igual que el Swedish National Ligament Registry(27), ha publicado una revisión en población de alto riesgo de rerrotura (atletas jóvenes de 14-22 años que ya hubieran sufrido una rotura del LCA). La tasa de rerrotura fue del 9,2% en la misma rodilla, del 11,2% en la pierna contralateral y del 19,7% para cualquiera de las dos. Los factores más influyentes para este evento fueron: laxitud articular previa (OR: 2,1), injerto de isquiotibiales (OR: 2,1) y edad (OR: 0,8)(51).
Wright et al.(55) presentaron una revisión sistemática de 21 estudios que valoraban los resultados tras la cirugía del LCA. La puntuación media subjetiva del IKDC fue de 74,8 ± 4,4, la puntuación del IKDC objetiva en nivel A o B fue de 71,1 ± 5,4%, la puntuación media de Lysholm de 82,1 ± 3,3, la puntuación media de Tegner de 6,1 y la puntuación media de Cincinnati de 81. La satisfacción global del paciente fue del 80%; sin embargo, la vuelta al nivel de actividad previo sin restricciones fue del 54%. Son resultados similares a los de otras revisiones(12,27,51). El fracaso de la cirugía del LCA valorado objetivamente (reintervención, > 5 mm de laxitud comparada con la extremidad contralateral o grados 2-3 de pivot shift) ocurrió en el 13,7 ± 2,7%(45).
Los deportes de pivotaje han estado siempre en el punto de mira. Aunque el 70% de las lesiones del LCA suceden en una entorsis de rodilla sin contacto, los deportes con mayor contacto tienen mayor riesgo de lesión(51). La tasa de rerrotura llega al 34% en grupos de altísimo riesgo (mujeres jóvenes en deportes de pivotaje)(27,57,58).
Resolución de problemas al nivel de los túneles
Son varias las situaciones que nos podemos encontrar en lo que se refiere a los túneles:
1. Túneles correctos y en buen estado. Situación ideal en la que, tras una buena limpieza artroscópica minuciosa de los túneles (Figura 20) y la retirada del tejido fibroso, procederemos al recambio simple de la plastia.
2. Túneles en posición no anatómica. En caso de tener suficiente espacio para nuestra plastia, procederemos a su sustitución con nuevos túneles en posición anatómica (Figura 21). Deberemos tener precaución para evitar el colapso del túnel previo. Si hubiera tornillo en dicho túnel y no interfiere con el nuevo túnel, se podría mantener. En caso de no estar ocupado por material, valoraremos el relleno del antiguo túnel (cilindros de injerto óseo, de sustitutivo óseo o, incluso, con un tornillo)(59).
3. Túneles cuasianatómicos, parcialmente ocupados por el material de fijación previo. Podemos realizar varios enfoques, ya que no siempre será necesario retirar los tornillos o sistemas de fijación anteriores, evitando así una pérdida ósea excesiva. Cuando nos encontremos un tornillo de material biorreabsorbible, deberemos proceder a una limpieza exhaustiva del túnel y al cambio en el sistema de fijación (suspensión cortical, por ejemplo). En caso de hallar un tornillo metálico, podemos apoyarnos en este sin necesidad estricta de retirarlo, siempre y cuando nos permita suficiente superficie de contacto óseo para la correcta integración de la plastia. En ambos casos, deberemos aplicar el concepto de “divergencia de túneles” en la creación de los nuevos túneles (Figura 22). Las nuevas guías flexibles y las brocas retrógradas outside-in son de ayuda en estos casos, ya que garantizan un punto de entrada articular deseado, pudiendo modificar posteriormente la dirección del canal óseo para evitar la comunicación de los mismos y una consecuente debilidad en la fijación de nuestro injerto. Debemos evitar el temido efecto de “cañón de escopeta”. De la misma manera, en el caso del túnel tibial, puede ser necesario su relleno con injerto óseo y el cambio de angulación de la guía tibial (medialización/lateralización del mismo).
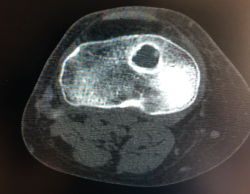
4. Túneles en posición anatómica y excesivamente dilatados (Figura 23). Cualquier túnel de más de 15 mm de diámetro es susceptible de una revisión en 2 tiempos. Un primer tiempo para el relleno con injerto óseo y, una vez integrado el injerto, aproximadamente unos 6 meses después, un segundo tiempo para la ligamentoplastia definitiva. Este procedimiento en 2 tiempos es también recomendable en casos de fístula de líquido sinovial a través del túnel o de plastias artificiales con intensa sinovitis reactiva(9).
Algunos autores, sin embargo, se inclinan por el relleno del túnel dilatado con tornillos de gran diámetro o técnica del doble tornillo. También está descrita la “fijación híbrida” con doble sistema de fijación –tornillo más grapa en tibia o tornillo más sistema de suspensión cortical en fémur (Figura 21)–.
5. Pared posterior insuficiente en el túnel femoral. Los sistemas de suspensión cortical serán de ayuda en estos casos, al ser un dispositivo de fijación que no depende exclusivamente de la integridad del canal óseo. Mediante la divergencia de túneles anteriormente mencionada, deberemos buscar una orientación que permita la mejor calidad ósea posible en el nuevo túnel (Figura 24).
Reconstrucción en 2 tiempos
La revisión en 2 tiempos es recomendable en todas aquellas circunstancias en que el tratamiento en un solo tiempo pueda resultar en un subóptimo resultado.
Son indicaciones absolutas para la revisión en 2 tiempos la infección, el túnel óseo > 15 mm, la artrofibrosis asociada con limitación de la movilidad o la retirada de material de osteosíntesis (RMO) que cause defecto óseo importante.
Las ventajas de la revisión en 2 tiempos son una mejoría en el balance articular postoperatorio y la posibilidad de realizar un segundo tiempo similar al primario de reconstrucción del LCA. Entre sus inconvenientes se encuentran una mayor posibilidad de lesión meniscal y de cartílago entre las 2 intervenciones, un mayor riesgo quirúrgico y una rehabilitación prolongada.
Conclusiones
A pesar de que la definición de fracaso de la cirugía de reconstrucción del LCA es controvertida, se han identificado múltiples factores responsables de dicho fracaso. La tasa de fracasos es variable según las series y probablemente sea mayor de la reportada.
La mayor parte de la bibliografía existente es heterogénea en relación con el tipo de pacientes, la técnica quirúrgica primaria y de revisión, las lesiones concomitantes y los procedimientos adicionales realizados durante la revisión(12,55).
Los resultados clínicos después de una revisión del LCA están ampliamente basados en estudios de nivel de evidencia bajo, siendo los estudios más frecuentes los de series de casos (32%), seguidos de los estudios de casos-controles aleatorizados (9,2%).
Los errores técnicos durante el acto quirúrgico son uno de los factores más relacionados con el fracaso. La continua actualización de la industria y de los implantes en relación con la cirugía de la rodilla, aun suponiendo un gran avance técnico, es también una fuente de potencial riesgo. Cirujanos con un corto volumen de cirugías artroscópicas se exponen a permanecer largo tiempo en una constante curva de aprendizaje. La elección del injerto, los diferentes sistemas de fijación y la colocación de los túneles serán los mayores retos en la consecuente cirugía de recambio de plastia del LCA.
Existe un consenso general acerca de que los resultados de la revisión de la cirugía del LCA son inferiores a la reconstrucción primaria(53). Se puede contribuir a reducir la incidencia de estas complicaciones realizando una evaluación preoperatoria exhaustiva, incluido un diagnóstico exacto, planificando y ejecutando minuciosamente el procedimiento quirúrgico y aplicando un programa de rehabilitación postoperatoria supervisado(18).
Conceptos anatómicos, biomecánicos, técnicos, quirúrgicos y de cuidados postoperatorios claros son clave para minimizar este fracaso.
Tablas
Tabla 1. Clasificación etiológica de fracasos de la cirugía del ligamento cruzado anterior (porcentajes muy variables según las series)
Tabla 3. Clasificación clínica del fracaso de la cirugía de reconstrucción del ligamento cruzado anterior
Figuras
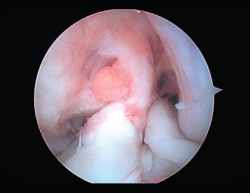
Figura 9. Cíclope, tejido fibroso interpuesto en la cara anterior de la plastia y que produce pinzamiento de la misma en extensión de rodilla.
Figura 15. Huella femoral utilizando el método de la cuadrícula en proyección de perfil radiológico. Posición ideal entre ambos puntos (centro de la huella y margen más posterior de esta).
Figura 16. Túnel tibial excesivamente anterior, riesgo de pinzamiento de la plastia, flexo, extrusión meniscal o rotura de la cortical anterior tibial.
Información del artículo
Cita bibliográfica
Autores
Aritz Ortega Centol
Unidad de Rodilla. Servicio de Cirugía Ortopédica y Traumatología. MC Mutual. Barcelona
Mónica García Guerrero
Unidad de Rodilla. Servicio de Rehabilitación. MC Mutual. Barcelona
Anna Castelló Egea
Unidad de Pediatría. Centro de Atención Primaria Sanllehy. Barcelona
Juan Carlos Serfaty Soler
Unidad de Sépticos. Clínicas MC Mutual. Barcelona
Servicio de Ortopedia y Traumatología. Clínicas MC Mutual Barcelona
Clínica MC Copérnico. Barcelona
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Financiación. Los autores declaran que este trabajo no ha sido financiado.
Conflicto de interés. Los autores declaran no tener ningún conflicto de intereses.
Referencias bibliográficas
-
1Johnson DL, Fu RH. Anterior cruciate ligament reconstruction: why do failures occur? Instr Course Lect. 1995;44:391-406.
-
2McGinty JB. Operative Arthroscopy. 3.rd ed. Williams & Wilkins; 2005. pp. 347-65.
-
3Brown CH, Carson EW. Revision anterior cruciate ligament surgery. Clin Sports Med. 1999;18:109-71.
-
4Shelbourne KD, Gray T. Results of anterior cruciate ligament reconstruction based on meniscus and articular cartilage status at the time of surgery. Am J Sports Med. 2000;28:446-52.
-
5Johnson DL, Harner CD, Maday MG, Fu FH. Revision anterior cruciate ligament surgery. En: Fu FH, Harner CD, Vince KG (eds.). Knee Surgery. Vol. 1. Baltimore: Williams & Wilkins; 1994. pp. 877-95.
-
6Murrell GAC, Maddali S, Horovitz L, Oakley SP, Warren RF. The effects of time course after anterior cruciate ligament injury in correlation with meniscal and cartilage loss. Am J Sports Med. 2001;29:9-14.
-
7Harner CD, Giffin JR, Dunteman RC, Annunciata CC, Friedman MJ. Evaluation and treatment of recurrent instability after anterior cruciate ligament reconstruction. Instr Course Lect. 2001;50:463-74.
-
8George MS, Dunn WR, Spindler KP. Current concepts review: revision anterior cruciate ligament reconstruction. Am J Sports Med. 2006;34:2026-37.
-
9Cugat Bartomeu R, Samitier Solís G, Álvarez Díaz P, Steinbacher G. Fracaso de la cirugía del LCA. Trauma Fund MAPFRE. 2008;19(1):55-75.
-
10Grossman MG, El-Attrache NS, Shields CL, Glousman RE. Revision anterior cruciate ligament reconstruction: three-to-nine-year follow-up. Arthroscopy. 2005;21:418-23.
-
11Alford JW, Bach BR Jr. Arthrometric aspects of anterior cruciate ligament surgery before and after reconstruction with patellar tendon grafts. Tech Orthop. 2005;20:421-38.
-
12Anderson MJ, Browing WM, Urband CE, Kluczynsky MA, Bisson LJ. A systematic Summary of Systematic Reviews on the topic of the anterior cruciate ligament. Orthop J Sports Med. 2016 Mar;4(3):2325967116634074.
-
13Zeng C, Cheng L, Wei J, Gao SG, Yang TB, Luo W, et al. The influence of the tibial plateau slopes on injury of the anterior cruciate ligament: a meta-analysis. Knee Surg Sports Traumatol Arthrosc. 2014;22:53-65.
-
14Zeng C, Gao SG, Wei J, Yang TB, Cheng L, Luo W, et al. The influence of the intercondylar notch dimensions on injury of the anterior cruciate ligament: a meta-analysis. Knee Surg Sports Traumatol Arthrosc. 2013;21:804-15.
-
15Hewison CE, Tran MN, Kaniki N, Remtulla A, Bryant D, Getgood AM. Lateral Extra-articular Tenodesis reduces rotational laxity when combined with anterior cruciate ligament reconstruction: a systematic review of the literature. Arthroscopy. 2015 Oct;31(10):2022-34.
-
16Paulos LE, Wnorowski DC, Beck CL. Rehabilitation following knee surgery: recommendations. Sports Med. 1991;11:257-75.
-
17Crawford SN, Waterman BR, Lubowitz JH. Long-term failure of anterior cruciate ligament reconstruction. Arthroscopy. 2013;29:1566-71.
-
18Wetsler MJ, Bartolozzi AR, Gillespie MJ, Rubenstein DL, Ciccotti MG, Miller LS. Revision anterior cruciate ligament reconstruction. Oper Tech Orthop. 1996;6:181-9.
-
19Graf B, Uhr F. Complications of intra-articular anterior cruciate ligament reconstruction. Clin Sports Med. 1988;17:835-48.
-
20Clancy WG, Narechania RG, Rosenberg TD. Anterior and posterior cruciate ligament reconstruction in Rhesus monkeys. J Bone Joint Surg Am. 1981;63(8):1270-84.
-
21Aglietti P, Buzzi R, D’Andria S. Patellofemoral problems after intraarticular anterior cruciate ligament reconstruction. Clin Orthop. 1993;288:195-204.
-
22Richmond JC, Assal MA. Arthroscopic management of arthrofibrosis of the knee, including infrapatellar contraction syndrome. Arthroscopy. 1991;7;144-7.
-
23Noyes FR, Barber-Westin SD. Reconstruction of the anterior and posterior ligaments after knee dislocation: use of early protected postoperative motion to decrease arthrofibrosis. Am J Sports Med. 1997;25:769-78.
-
24Shelbourne KD, Wilckens JH, Mollabashy A, DeCarlo M. Arthrofibrosis in acute anterior cruciate ligament reconstruction. The effect of timing of reconstruction and rehabilitation. Am J Sports Med. 1991;19:332-6.
-
25Paulos LE, Wnorowski DC, Beck CL. Rehabilitation following knee surgery: recommendations. Sports Med. 1991;11:257-75.
-
26McPherson AL, Feller JA, Hewett TE, Webster KE. Psychological readiness to Return to Sport is associated with second anterior cruciate ligament injuries. Am J Sports Med. 2019 Mar;47(4):857-62.
-
27Sandon A, Engström B, Forssblad M. High risk of further anterior cruciate ligament injury in a 10-Year follow-up study of anterior cruciate ligament-Reconstructed soccer players in the Swedish National Knee Ligament Registry. Arthroscopy. 2020 Jan;36(1):189-95.
-
28Poolman RW, Abouali JAK, Conter HJ, Bhandari M. Overlapping systematic reviews of anterior cruciate ligament reconstruction comparing hamstring autograft with bone-patellar tendon-bone autograft: why are they different? J Bone Joint Surg Am. 2007;89(7):1542-52.
-
29Noonan BC, Bachmaier S, Wijdichs CA, Bedi A. Independent suture tape reinforcement of tripled smaller-diameter and quadrupled grafts for anterior cruciate ligament reconstruction with tibial screw fixation: a biomechanical full construct model. Arthroscopy. 2020;36(2):481-9.
-
30Janssen RP, Scheffler SU. Intra-articular remodelling of hamstring tendon grafts after anterior cruciate ligament reconstruction. Knee Surg Sports Traumatol Arthrosc. 2014;22:2102-28.
-
31Pauzenberger L, Syre S, Schurz M. “Ligamentization” in hamstring tendon grafts after anterior cruciate ligament reconstruction: a systematic review of the literature and a glimpse into the future. Arthroscopy. 2013;29:1712-21.
-
32Odensten M, Gillquist J. Functional anatomy of anterior cruciate ligament and rationale for reconstructions. J Bone Joint Surg Am. 1985;67(2):257-62.
-
33Śmigielski R, Zdanowicz U, Drwięga M, Ciszek B, Ciszkowska-Łysoń B, Siebold R. Ribbon like appearance of the midsubstance fibres of the anterior cruciate ligament close to its femoral insertion site: a cadaveric study including 111 knees. Knee Surg Sports Traumatol Arthrosc. 2015 Nov;23(11):3143-50.
-
34Bradley J, Fitz Patrick D, Daniel D, Shercliff T, O’Connor J. Orientation of the cruciate ligament in the sagittal plane: a method of predicting its length-change with flexion. J Bone Joint Surg Br. 1988;70(1):94-9.
-
35Amis AA, Dawkins GP. Functional anatomy of the anterior cruciate ligament: fiber bundle actions related to ligament replacement and injuries. J Bone Joint Surg Br. 1991;73(2):260-7.
-
36Abe S, Kurosaka M, Iguchi T, Yoshiya S, Hirohata K. Light and electron microscopic study of remodeling and maturation process in autogenous graft for anterior cruciate ligament reconstruction. Arthroscopy. 1993;9(4):394-405.
-
37Falconiero RP, DiStefano TM, Cook TM. Revascularization and ligamentization of autogenous anterior cruciate ligament grafts in humans. Arthroscopy. 1998 Mar;14(2):197-205.
-
38Sánchez M, Anitua E, Azofra J, Prado R, Muruzabal F, Andia I. Ligamentization of tendon grafts treated with an endogenous preparation rich in growth factors: gross morphology and histology. Arthroscopy. 2010 Apr;26(4):470-80.
-
39Rougraff B, Shelbourne KD, Gerth PK, Warner J. Arthroscpic and histologic analysis of human patellar tendon autografts used for anterior cruciate ligament reconstruction. Am J Sports Med. 1993 Mar-Apr;21(2):277-84.
-
40Drez DJ, DeLee J, Holden JP. Anterior cruciate reconstruction using bone-patellar tendon-bone allografts: a biological and biomechanical evaluation in goats. Am J Sports Med. 1991;19:256-63.
-
41Bernard R, Bach. Revision Anterior Cruciate Ligament Surgery: Instrucional Course 102. Arthroscopy. 2003;19(Suppl 1):14-29.
-
42Odensten M, Gillquist J. Functional anatomy of anterior cruciate ligament and rationale for reconstructions. J Bone Joint Surg Am. 1985;67(2):257-62.
-
43Fanelli GC, Giannotti BF, Edson DJ. The posterior cruciate ligament arthroscopic evaluation and treatment. Arthroscopy. 1994;10:673-88.
-
44Getelman MH, Schepsis AA, Zimmer JE. Revision ACL reconstruction: autograft versus allograft. Arthroscopy. 1995;11:378.
-
45De Valk EJ, Moen MH, Winters M, Bakker EW, Tamminga R, van der Hoeven H. Preoperative patient and injury factors of successful rehabilitation after anterior cruciate ligament reconstruction with single-bundle techniques. Arthroscopy. 2013;29:1879-95.
-
46Kim SJ, Postigo R, Koo S, Kim JH. Infection after arthroscopic anterior cruciate ligament reconstruction. Orthopedics. 2014;37:477-84.
-
47Saper M, Stephenson K, Heisey M. Arthroscopic irrigation and debridement in the treatment of septic arthritis after anterior cruciate ligament reconstruction. Arthroscopy. 2014;30:747-54.
-
48Wang C, Lee YH, Siebold R. Recommendations for the management of septic arthritis after ACL reconstruction. Knee Surg Sports Traumatol Arthrosc. 2014;22:2136-44.
-
49Washer DC, Becker JR, Dexter KG, Blevins FT. Knee dislocation: initial assessment and implications for treatment. J Orthop Trauma. 1997;11:525-9.
-
50Ardern C, Ekas G, Grindem H, Moksnes H, Anderson A, Chotel F, et al. 2018 International Olympic Committee Consensus Statement On Prevention, Diagnosis and Management of Paediatric Anterior Cruciate Ligament (ACL) Injuries. Knee Surg Sports Traumatol Arthrosc. 2018 Apr;26(4):989-1010.
-
51MOON Knee Group, Spindler KP, Huston LJ, Zajichek A, Reinke EK, Amendola A. Anterior cruciate ligament reconstruction in High School and College-Aged Athletes: Does autograft choice influence anterior cruciate ligament revision rates? Am J Sports Med. 2020;48:298-309.
-
52Montalvo A, Schneider D, Webster K, Yut L, Galloway MT, Heidt Jr RS, et al. Anterior cruciate ligament injury risk in sport. A systematic review and meta-analysis of injury incidence by sex and sport classification. J Athl Train. 2019 May;54(5):472-82.
-
53Prodromos CC, Joyce BT, Shi K, Keller BL. A meta-analysis of stability after anterior cruciate ligament reconstruction as a function of hamstring versus patellar tendon graft and fixation type. Arthroscopy. 2005;21:1202.
-
54Samuelsson K, Desai N, McNair E, van Eck CF, Petzold M, Fu FH, et al. Level of evidence in anterior cruciate ligament reconstruction research: a systematic review. Am J Sports Med. 2013;41:924-34.
-
55Wright RW, Gill CS, Chen L, Brophy RH, Matava MJ, Smith MV, et al. Outcome of revision anterior cruciate ligament reconstruction: a systematic review. J Bone Joint Surg Am. 2012;94:531-6.
-
56Posthumus M, Collins M, September AV, Schwellnus MP. The intrinsic risk factors for ACL ruptures: an evidence-based review. Phys Sportsmed. 2011;39:62-73.
-
57Serpell BG, Scarvell JM, Ball NB, Smith PN. Mechanisms and risk factors for noncontact ACL injury in age mature athletes who engage in field or court sports: a summary of the literature since 1980. J Strength Cond Res. 2012;26:3160-76.
-
58Balazs GC, Pavey GJ, Brelin AM, Pickett A, Keblish DJ, Rue JP. Risk of anterior cruciate ligament injury in athletes on synthetic playing surfaces: a systematic review. Am J Sports Med. 2014;43:1798-804.
-
59Curso de Actualización en Técnicas de Cirugía de Rodilla. Vall d’Hebron; 2020.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- ¿Para qué <em>RETLA</em>?
- Seguimos con más fuerza
- Sacando todo el jugo a las pruebas complementarias
- Nuevos retos meniscales. Salvar el menisco
- Lesiones multiligamentosas. De la tríada a la péntada, ¿qué es lo que verdaderamente sabemos?
- Fracaso de la reconstrucción del ligamento cruzado anterior. Revisión de la literatura
- Nuevos enfoques en las fracturas de meseta tibial
- Procedimientos anestésicos y analgésicos en cirugía articular de rodilla
- Fracturas de calcáneo tratadas mediante abordaje del seno del tarso mínimamente invasivo
- Estudio de 87 pacientes con mordedura animal atendidos en urgencias
- Registros del dolor en hospitalización
- Tratamiento de lesión multidigital con colgajo inguinal libre en sindactilia
- Tratamiento de lesión osteocondral astragalina. Acceso transindesmótico
- Síndrome compartimental agudo de la mano postinfección, tras inoculación accidental en partes blandas de sustancia alimenticia. A propósito de un caso clínico
Más en PUBMED
Más en Google Scholar


Revista Española de Traumatología Laboral está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.